杜永峰1,于銘2,閆燁1
(1. 西安理工大學理學院應用化學系,陜西西安710048; 2. 第四軍醫大學西京醫院超聲科,陜西西安710032)
Advances in the materials of microbubble unltrasound contrast agents
DU Yong-feng1, YU Ming2, YAN Ye1
(1. Department of Applied Chemistry, School of Sciences, Xi’an University of Technology, Xi’an 710048, China;
2. Ultrasound Division, Xijing Hospital, Fourth Military Medical University, Xi’an 710032, China)
Abstract:Ultrasound contrasta agents (UCA)are a new kind of diagnostic drugs which can greatly enhance the medical ultrasound signals. The presence of UCA opens a new field in non-damaging ultrasound medical examination. In this paper, materials used in the present UCA are reviewed. According to their different membrane materials, some new UCA are introduced from the viewpoints of preparation. Potential combinations of UCA with targeted drug delivery system are simply summarized. Besides, some relevant results obtained by us are also introduced.
Key words:ultrasound contrast agent;microbubble;ultrasound imaging;targeted drug delivery system
摘要:超聲造影劑(UCA)是一類能夠顯著增強醫學超聲檢測信號的診斷藥劑,UCA的出現,開創了無創超聲醫學的一個新領域。本文對目前應用于微泡超聲造影劑的各種材料進行了評述,并按膜材料的不同,從制備角度出發介紹了一些最新的造影劑,介紹了微泡超聲造影劑目前在靶向制劑領域的融合,文中還介紹了我們開展的一些工作。
關鍵詞:超聲造影劑;微泡;超聲成像;靶向制劑
中圖分類號:TQ423.9 文獻標識碼:A
文章編號:1001-9731(2004)增刊-2473-04
1 引言
超聲造影劑(ultrasound contrast agent, UCA)是一類能夠顯著增強醫學超聲檢測信號的診斷藥劑,在人體微小血管和組織灌注檢測與成像方面,使用UCA進行超聲檢測具有成像效果好、實時、操作簡便、無離子輻射、無損性、適用面廣等優點,因此在醫學臨床檢測中得到了越來越多的應用[1~3]。超聲成像基于回波信號的反射強度,微泡具有較強的回波反射性能,目前被認為是最好的人體微管內的造影材料。以微泡制成的超聲造影劑稱為微泡型超聲造影劑(microbble ultrasound contrast agents, mUCA),現在作為聲學造影劑應用的一般均是微泡型的造影劑,因此微泡型超聲造影劑可簡化稱為UCA。UCA的出現,開創了無創傷超聲醫學的一個嶄新的領域,除了作為超聲診斷藥劑之外,近年來還發現UCA具有分子成像、促進血栓溶解、促進基因轉染及藥物體內運輸定點釋放等作用[4~7],這使得UCA也成為目前醫學領域的一個研究熱點。
近幾年來,國外UCA的制備及其應用研究十分活躍,而國內UCA的制備研究基本以聲空化人血清白蛋白為主,其研究及應用基本停留于國外上個世紀90年代初的水平,并且國內目前還沒有UCA的生產廠家,而國外生產的各種UCA都過于昂貴, 一瓶一百多美元的UCA只能用于一次超聲造影。越來越多的研究顯示,UCA目前已成為醫學超聲檢測上必不可少的診斷藥劑,UCA在其它醫學領域還顯示著許多誘人的應用前景,因此在我國研究開發UCA的制備技術具有巨大的研究和實際應用價值。UCA的發展經歷了早期的以實驗用生理鹽水、染料、膠體、乳液和含有自由氣泡的液體為代表的第一代聲學造影劑,以包裹室內空氣的人血清白蛋白微泡為代表的第二代聲學造影劑。1993年由于新的發現,微泡的氣體材料得到了重視,1995年后,出現了以全氟化碳等高分子量氣體作為微泡內的填充氣體,自此形成了第三代穩定微泡超聲造影劑。目前,UCA正在向具備有靶向診斷(包括分子成像)、靶向載藥的第四代功能性聲學造影劑方面發展。
2 微泡造影劑的包膜材料
1972年Ziskin[8]發現造影效果是由液體中的氣體形成的氣泡導致的,因此他認為造影效果是由所選液體的物理化學性質決定的,當然這一結論目前看來并不完全正確。受Ziskin的影響,人們后來開始嘗試采用各種液體介質作為微氣泡的膜,如生理鹽水、右旋糖苷、山梨醇、膠體溶液、人血清白蛋白等。目前,已有多種材料被用來作為微泡的膜,這里我們將其分類介紹如下,同時按照主要膜材料的不同分別介紹目前最新研究和應用的微泡超聲造影劑。
2.1 表面活性劑類
由于表面活性劑本身的特性,目前已制備出的超聲造影劑中大都或多或少含有一些表面活性劑成份,如AF0150中就含有少量的表面活性劑,AF0150 是美國Alliance制藥公司生產的微泡超聲造影劑,AF0150是采用干燥方法制成的粉體,粉體其中含有表面活性劑、鹽、緩沖物質,粉體以全氟化碳氣體飽和并儲存在密閉小瓶中,使用時注入無菌水就會形成微泡,微泡平均尺寸5μm,濃度5×108個/ml[9]。目前的ST系列造影劑的膜材料是基于表面活性劑的,這里,S指的是Span類表面活性劑,T指的是Tween類,Span類和Tween類均為非離子表面活性劑。ST系列中常見的是ST44 和ST68,ST44 采用Tween40 和Span60,ST68采用Span60 and Tween80,微泡中的氣體已采用的有空氣、全氟丁烷和六氟化硫。大部分基于表面活性劑微泡的制備方法可以采用聲空化、冷凍干燥、熱氣流干燥等。ST68平均直徑為3.8μm,濃度為7.1×108/ml, ST68在4~6周內微泡濃度無明顯變化。Wheatley等發現穩定的表面活性劑微泡組成中一般包含一種液態表面活性劑和一種固態表面活性劑,此外,Span類表面活性劑僅Span40和Span60能和Tween類除Tween85之外的其它Tween類表面活性劑形成穩定微泡,從HLB值上來說,穩定微泡的組成成分里需要含一種HLB>10.5的表面活性劑和一種HLB<9的表面活性劑[10]。
2.2 蛋白質類
蛋白質類物質以人血清白蛋白用于超聲造影劑的研究及臨床應用最多,制備方法采用聲空化法,白蛋白濃度取為5%。在蛋白質中加入一些助劑,可以顯著提高蛋白質微泡的性能,文獻[11]中介紹在蛋白質中加入蔗糖形成的氣泡分散性好,而且在加熱的情況下也不破裂,基于這一結果,我們將其用于制備造影劑微泡,通過在5%人血清白蛋白中加入40%蔗糖,并通入全氟丙烷氣體,制得了十分穩定的白蛋白微泡[12]。也有研究者在蛋白質中加入葡萄糖及右旋糖酐來改善微泡性能。美國Molecular Biosystems公司生產的Albunex是最早上市的微泡超聲造影劑,該公司近來還開發出了Optison微泡造影劑,Optison采用1%人血清白蛋白,包裹的氣體是全氟丙烷[13]。Porter TR和Xie F 等開發的PESDA為聲空化50%右旋糖苷、5%人血清白蛋白,微泡內氣體為全氟化碳,據其報道可以實現較好的心肌顯影,PESDA濃度為5×109~6×109個/ml,平均直徑4.7±0.3μm[14]。
2.3 脂類物質
脂類物質尤其是脂質體作為UCA膜材料的研究近年來也較多一些。脂類形成的UCA膜可以分為兩種:一種膜中的脂質分子為單層排列;另一種膜中的脂質形成類似于細胞膜的雙分子層結構。脂類UCA一般均較穩定,放置時間也較長。脂質體是當兩親分子如磷脂分子分散在水中時,能自發形成磷脂雙分子包裹溶液的球形封閉小囊泡,即為脂質體。脂質體的粒徑一般在幾十個納米到幾個微米之間。以脂質體通過化學修飾可以制成具有靶向功能的微泡造影劑,在特定的器官部位聚集,實現對該部位的最佳造影效果。一般來說,飽和脂質體作為微泡膜要比不飽和脂質體好一些,因為飽和脂質體在生理溫度下以凝膠形式存在而不飽和脂質體以液晶形式存在。凝膠狀態的脂質體內部烷基基團的排列要比液晶形式存在的脂質體緊密得多,因此做成的膜使氣體分子更難以滲透通過。如二棕櫚酰磷脂酰膽堿為一烷基上有16個碳原子的飽和磷脂,其相變溫度為42℃,生理溫度下則以難被氣體透過的凝膠形式存在[15,16]。德國ByK Gulden 公司開發的BY963以3-磷脂酰-甘油基-二硬脂酰的鈉鹽為膜材料,該材料類似于生物細胞膜的基本成分,即含硬脂酸的飽和磷脂。
2.4 聚合物
聚合物作為微泡UCA的膜材料是因為分子間的作用力較強,從而使膜的穩定性較高。聚合物一般需要通過交聯的方法來制備微泡液膜,在UCA中已采用的高分子材料有聚乙二醇4000、聚丁基-2-氰基丙烯酸酯、多聚糖、海藻酸鹽等。聚合物膜可以做得非常薄,如以聚丁基-2-氰基丙烯酸酯為微泡膜時的厚度接近100nm,而且膜的彈性好,形成的微泡非常穩定,能夠忍受巨噬細胞的吞噬,從而實現淋巴等部位的被動靶向造影[17]。瑞士Bracco Research公司采用凍干法制備出聚乙二醇的空心干粉,再與六氟化硫混合物密封保存,開發出了BR1微泡超聲造影劑,該造影劑使用時同其它干粉劑一樣,需加入無菌水,即得到微泡。Sonus公司生產的氣液相變型造影劑Echogen,采用了表面活性劑微乳化非離子聚合物和2.2%全氟戊烷異構體混合物,乳化液滴的直徑為0.2μm,在29℃下,全氟戊烷由液體轉變為氣體,形成的微泡的體積較原來液滴增大2.8倍,在生理溫度下,微泡直徑進一步增大達到2~3μm,成為超聲波的強反射體。
2.5 糖類物質
基于糖類物質的微泡超聲造影劑一般均具有很好的安全性和生物相容性。多聚糖如淀粉可被加入到一些配方中用來提高微泡的穩定性,因為加入淀粉可以增強微泡膜分子之間的作用力。單糖和寡聚糖分子較小,相互作用力不強,形成微泡的方法不同于淀粉等多聚糖,單糖和寡聚糖用來制備微泡時采用了氣泡形成的基本物理原理[18]:在任何被氣體過飽和的液體中,氣泡首先在液體中的一些固體表面形成,如容器表面和分散在液體中的糖類物質的固體粉末位點,而且形成的氣泡可以存在很長時間。采用這一原理制備出的微泡尺寸分布集中,微泡也有足夠的存在時間。德國Schering AG公司開發出了兩種基于半乳糖的微泡超聲造影劑Echovist和Levovist, 這兩種造影劑均是首先通過干燥的方法制成粉末,使用時將定量的粉末與水溶液混合,然后劇烈搖動數秒鐘,這些粉末會首先會分散成更小的微粒,這些微粒則會成為微泡形成的位點,最后形成了的溶液每ml含有200~400 mg的微泡。微粒的尺寸決定了圍繞其形成的微泡的尺寸,形成的微泡溶液約2min后達到平衡,隨后可以保持約10min的超聲回波能力。Echovist 和Levovist 化學組成基本相同,只是Levovist成分中多了0.1%的棕櫚酸,這一少量的棕櫚酸顯著增強了Levovist微泡的穩定性,使其可以通過肺循環而進入動脈循環。這些造影劑靜脈注射后,微泡附著的半乳糖微粒會溶解,微泡則繼續存在,形成回波加強了的血流。
3 微泡超聲造影劑及其造影效果
圖1時我們采用表面活性劑及其助劑制備的微泡超聲造影劑顯微圖片(×100),微泡平均直徑3.95μm,微泡濃度3.6x109個/ml[19,20]。

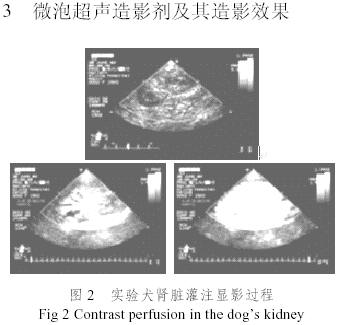
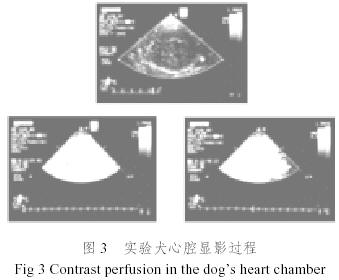
圖2是我們采用圖1所示的微泡造影劑進行的試驗犬腎臟血流灌注造影實驗結果,圖3是試驗犬心腔造影實驗結果,從圖2和圖3可以清晰看出微泡超聲造影劑的造影效果。
4 微泡超聲造影劑與靶向制劑
利用靶向分子導向一直是非常活躍的一個研究領域,但由于目前對生物體本身各類生化作用的特異性還遠缺乏了解,這對該方法的應用產生了一個目前仍然無法克服的瓶頸效應。采用在微米微泡及亞微米或納米載藥微球膜上分別引入能發生相互作用的分子或基團,然后將微泡與微球載藥體按一定比例連接,靜脈注入體內后,在特定組織部位通過超聲引爆微米微泡,利用微泡崩潰時產生的能量將周圍連接的微球擊碎,從而達到藥物及微泡的靶向運輸與控制釋放的目的,這一過程可以同時實現造影與釋藥,即同時實現診斷與治療的目的。由于不涉及體內的生化反應,而微泡與微球的連接很容易通過一些化學方法實現如羧基與氨基之間的作用等,此外由于體外超聲引爆微米微泡的無損性、安全性和可控性在微泡超聲造影劑的應用中已得到廣泛證實,因此認為這一方案可能會成為今后較短時期內靶向給藥及控制釋放的突破點。除了可以在微泡表面接入載藥微球之外,也可在微泡制備時將藥物包裹在微泡中,形成同時包裹藥物和氣體的載藥載氣的微泡體,如果在內部包裹藥物的表面接入靶向分子,則可以實現微泡定向引爆和靶向分子導向的雙重靶向作用。
參考文獻:
[1] Lindner, Jonathan R. Detection of inflamed plaques with contrast ultrasound. [J]. The American Journal of Cardiology Volume, 2002, 90(10): L32-L35.
[2] Hohmann J, Albrecht T, Hoffmann C W, etc. Ultrasono- graphic detection of focal liver lesions: increased sensitivity and specificity with microbubble contrast agents. [J]. European Journal of Radiology, 2003, 46: 147-159.
[3] Esteban J M, Molla C, Tomas L. Improved detection of liver metastases with contrast-enhanced wideband harmonic imaging: comparison with CT findings. [J]. European Journal of Ultrasound, 2002, 15: 119-126.
[4] Christiansen Jonathan P,Brent A. Alexander L. etc. Targeted tissue transfection with ultrasound destruction of plasmid-bearing cationic microbubbles. [J]. Ultrasound in Medicine and Biology, 2003, 29(12): 1759-1767.
[5] Shin-ichiro Miura, Katsuro Tachibana, Takahiro Okamoto, etc. In vitro transfer of antisense oligodeoxynucleotides into coronary endothelial cells by ultrasound. [J]. Biochemical and Biophysical Research Communications, 2002, 298: 587-590.
[6] Gawiyou Danialou, Alain S, Roy W R, et al. Ultrasound Increases Plasmid-Mediated Gene Transfer to Dystrophic Muscles without Collateral Damage. [J]. Molecular therapy, 2002, 6(5): 687-693.
[7] Evan C Unger, Thomas P McCreery, Robert H Sweitzer, etc. In Vitro Studies of a New Thrombus-Specific Ultrasound Contrast Agent. [J]. The american journal of cardiologyt, 1998, 81(12A): 58g-61g.
[8] Ziskin MC, Bonakdapour A, Wienstein DP, et al. Contrast agents for diagnostic ultrasound. [J]. Invest Radiol. 1972, 7:500.
[9] Christian Veltmann, Stefan Lohmaier, Thomas Schlosser, et al. On The design of a capillary flow phantom for the evaluation of ultrasound contrast agents at very low flow velocities.[J]. Ultrasound in Med. & Biol., 2002, 28(5): 625-634.
[10] Wheatley M A, Singhal S. Structural studies on stabilized microbubbles: development of a novel contrast agent for diagnostic ultrasound. [J]. Reactive polymers, 1995, 25: 157-166.
[11] 北原文雄. 表面活性劑[M]. [孫紹增譯]. 北京: 化學工業出版社, 1984.第48-49頁.
[12] 杜永峰, 萬明習, 趙文明. 含蔗糖白蛋白包膜微泡超聲造影劑制備研究. [J]. 藥學學報, 2001,36 (11): 859-862.
[13] Moran C M, Watson R J, Fox K A A, et al. In vitro acoustic characterisation of four intra- venous ultrasonic contrast agents at 30 mhz. [J]. Ultrasound in Med. & Biol., 2002, 28(6): 785-791.
[14] Porter T, Kricsfeld D, Cheatham S, et al. Effect of blood and microbubble oxygen and nitrogen content on perfluoro- carbon-filled dextrose albumin microbubble size and efficacy: in vitro and in vivo studies. [J]. J Am Soc Echocardiogr. 1998,11(5): 421-425.
[15] Lanza GM, Wallace KD, Scott MJ, et al. A novel site-targeted ultrasonic contrast agent with broad biomedical application. Circulation. [J]. 1996,94(12): 3334-3340.
[16] Alkan-Onyuksel H, Demos Sm, Lanza GM, et al. Develop- ment of inherently echogenic liposomes as an ultrasonic contrast agent. [J]. J Pharm Sci. 1996,85(5): 486-490.
[17] Dugstad Harald, Foss Per Antonius, Klaveness Jo, et al. Polymeric surfactant-encapsulated microbubbles and their use in ultrasound imaging. [P]. US Patent, No. 5,919,434, 1999.
[18] Barry B Goldberg. Ultrasound Contrast Agents.[M]. Published by Martin Dunitz Ltd (United Kingdom), 1997. p1-191.
[19] 杜永峰. 納米包膜造影微泡: 設計與實驗. [D]. 西安交通大學博士論文, 2003.6.
[20] 杜永峰, 萬明習, 王素品, 等. 基于表面活性劑的納米包膜微泡超聲造影劑研究. [J]. 化工學報, 2003, 54(6): 807-812.
作者簡介:杜永峰(1970-),男,西安人,博士,西安理工大學副教授,目前主要研究方向為新型微納米微泡超聲造影劑及其用于超聲診斷和分子成像的研究。E-mail: maildyf@yahoo.com.cn Tel: 029-82312770
論文來源:中國功能材料及其應用學術會議,2004年,9月12-16日