近紅外光激發的光熱治療可以有效彌補傳統癌癥治療手段的不足。但是目前常用的近紅外有機光熱分子(如花菁類等)的光穩定性差,其光降解會影響納米結構的穩定性和光熱轉化效率。因此,開發一種兼具高穩定納米結構和高光熱轉化效率的新型近紅外有機光熱試劑,將有效提高腫瘤的治療效率及醫學安全性。
近日,北京化工大學尹梅貞教授課題組報道了水溶性近紅外萊啉系光熱分子Quaterrylenediimide(QDI),其具有較高光熱轉化效率(64.7 ± 4%)以及近紅外吸收的特性(808 nm),重點研究了其光診療(光聲成像和光熱治療)性能,并進一步評價了其癌癥治療應用以及生物安全性。該課題組前期曾報道以萊啉系Terrylenediimide(TDI)、Perylenediimide(PDI)為核的光熱試劑,分別發表于ACS Nano (2017, 11, 3797–3805)及Sci Bull (2018, 63, 101-107) 等雜志。
該工作發表于Angew. Chem. Int. Ed.,題為“A Water-soluble, NIR-absorbing Quaterrylenediimide Chromophore for Photoacoustic Imaging and Efficient Photothermal Cancer Therapy”,DOI: 10.1002/anie.201810541 & DOI: 10.1002/ange.201810541。北京化工大學博士生劉暢為第一作者,尹梅貞教授為通訊作者。
如圖1所示,通過拓展Perylenemonoimide(PMI)分子的π-共軛度制備QDI,具有近紅外吸收(600 nm-1000 nm),運用大分子修飾策略,在“核”周圍引入拓撲結構水溶性“外殼”PEG,提高生物相容性及延長體內循環時間。在親疏水及π-π作用力驅動下,QDI大分子可以在水溶液中自組裝成超小納米膠束(10.8 ± 1.4 nm),有利于腫瘤組織深層滲透及體內有效代謝。在激光照射后實現高效的光熱升溫性能,在生物實驗中,表現出優異的光聲信號,高效的光熱治療效果及可靠的生物安全性。
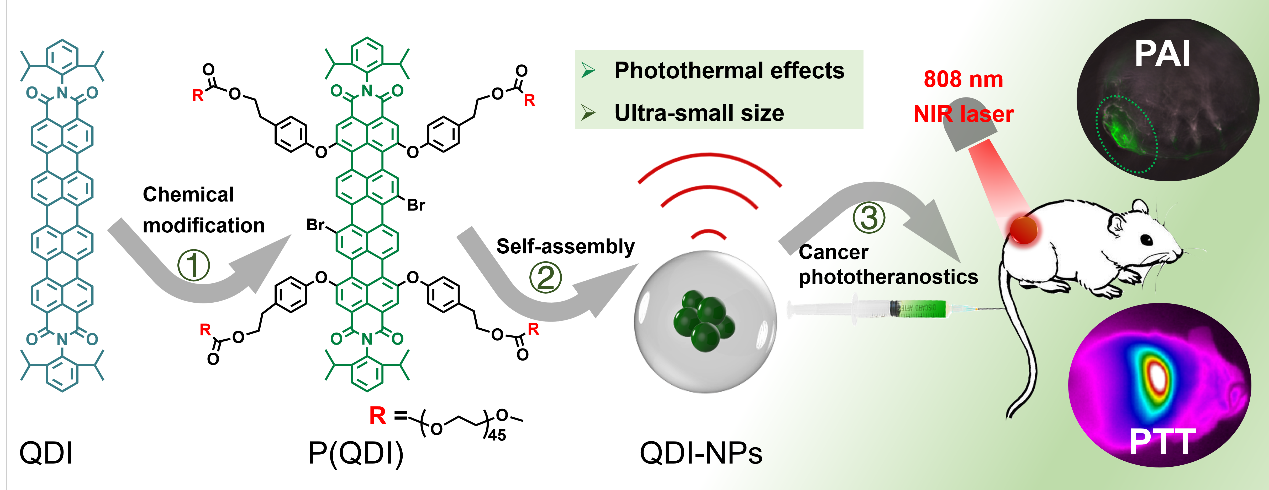
圖1 光診療試劑QDI-NPs的設計思路
在近紅外808 nm激光輻射下,QDI具有比大多數有機光熱試劑高的光熱轉化效率64.7±4%。隨后在細胞及活體水平驗證了QDI作為一種新型近紅外光熱分子對癌癥的光聲成像和光熱治療效果。QDI-NPs被動靶向到小鼠腫瘤組織過程中,通過光聲成像監測藥物在腫瘤組織的代謝動力學問題,并成功實現了腫瘤位置,形狀,尺寸等信息的可視化。在最佳藥物富集時間實施激光治療后,小鼠在觀察期內,完全治愈并且恢復健康,見圖2。
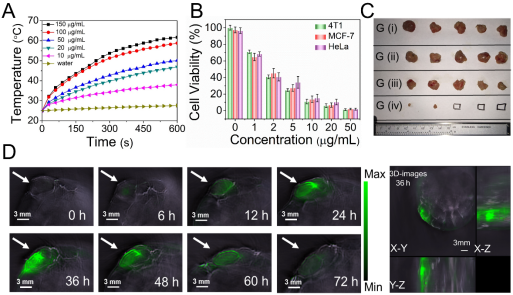
圖2 光診療試劑QDI-NPs的性能表征及生物應用
(A)不同濃度的QDI-NPs在PBS中的光照升溫曲線。
(B)QDI-NPs與細胞共培養的光照毒性。
(C)光熱治療后各組分小鼠腫瘤照片。
(D)尾靜脈注射QDI-NPs后,不同時間小鼠腫瘤組織光聲信號強度圖片(左)及36h腫瘤組織3D光聲信號圖片(右)。
他們制備的QDI光熱納米藥物具有以下三個特點:
1、超小、可控且穩定的納米結構和高生物相容性,有利于腫瘤組織深層滲透和從體內有效代謝;
2、近紅外吸收及高的光熱轉化效率,能穿透更深層組織及降低藥物劑量和激光輻射對生物體帶來的二次損害;
3、優異的光穩定性及較強的光聲信號,可實現腫瘤的光診療一體化研究。
該研究工作不僅為開發新型有機光熱試劑提供了思路,還豐富了現有光熱試劑的種類,為科學研究和臨床使用提供了更多的選擇和借鑒。
文章信息:
1. Chang Liu,Shaobo Zhang, Jianhao Li, Jie Wei, Klaus Müllen and Meizhen Yin*, A Water-soluble, NIR-absorbing Quaterrylenediimide Chromophore for Photoacoustic Imaging and Efficient Photothermal Cancer Therapy, Angew. Chem. Int. Ed., DOI: 10.1002/anie.201810541
2. Shaobo Zhang, Jianhao Li, Jie Wei, Meizhen Yin*, Perylenediimide Chromophore as An Efficient Photothermal Agent for Cancer Therapy, Sci. Bull., 2018, 63(2): 101-107.
3. Shaobo Zhang, Weisheng Guo, Jie Wei, Chan Li, Xing-Jie Liang*, and Meizhen Yin*, Terrylenediimide-Based Intrinsic Theranostic Nanomedicines with High Photothermal Conversion Efficiency for Photoacoustic Imaging-Guided Cancer Therapy, ACS Nano, 2017, 11 (4): 3797–3805.
文章鏈接:
https://onlinelibrary.wiley.com/doi/full/10.1002/anie.201810541
https://pubs.acs.org/doi/abs/10.1021/acsnano.6b08720
https://www.sciencedirect.com/science/article/pii/S2095927317306345
- 北京師范大學鄒應全教授團隊 CEJ:基于近紅外光聚合的立體光刻3D打印技術 2025-02-24
- 香港科大唐本忠院士團隊/武大王富安課題組 JACS:設計一種AIE螺環近紅外發射探針用于DNAzyme敏化增強的乳腺癌光熱治療 2024-12-14
- 桂工甄士杰/李美靜博士、廣醫張天富副教授、華工趙祖金教授、港中深唐本忠院士 AM:近紅外二區脂質體多模態光診療新成果 2024-11-29
- 東華大學郭睿教授/史向陽教授課題組《ACS AMI》:樹枝大分子包裹銅鉑雙金屬納米酶用于腫瘤微環境調控光熱/催化療法 2025-06-19
- 清華危巖、川師大白躍峰《npj Clean Water》: 高效光熱轉化聚合物水蒸發器助力水資源與鋰資源雙豐收 2025-06-06
- 東華大學熊佳慶/周欣然 Adv. Mater.:光熱響應氣凝膠-水凝膠二元仿生體系實現全天候水伏發電 2025-05-21
- 中科大王育才/蔣為團隊 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破腫瘤血管基底膜屏障,增強納米藥物瘤內遞送 2025-05-03
