癌癥是當前嚴重危害人類健康的重大疾病之一,傳統的癌癥治療方法如手術、化療和放療等存在有毒副作用、耐藥、復發和轉移等缺陷,納米藥物為腫瘤的精準治療提供了新的策略,用于腫瘤聯合治療納米藥物的研究得到了廣泛關注。光熱療法在溫和熱療條件(39-43 °C)下具有熱增敏效應(膜損傷、抑制DNA合成和修復、細胞骨架損傷和Na/K-ATP酶激活等),其產生的熱量可以促進化療藥物在腫瘤內的積累、滲透與釋放,因此,光熱化療在實現協同作用最大化和改善癌癥治療效果方面具有巨大的潛力。聚吡咯納米材料由于具有良好的光穩定性、高光熱轉化效率和優良的生物相容性,被廣泛研究用于光熱治療。然而,由于共軛高分子鏈缺少功能團難以進行修飾,因此探索一種有效的方法來構建水溶性的聚吡咯納米粒并同時賦予其高載藥量和藥物精準釋放的性能、以實現光熱化療協同效果仍具有一定的挑戰。
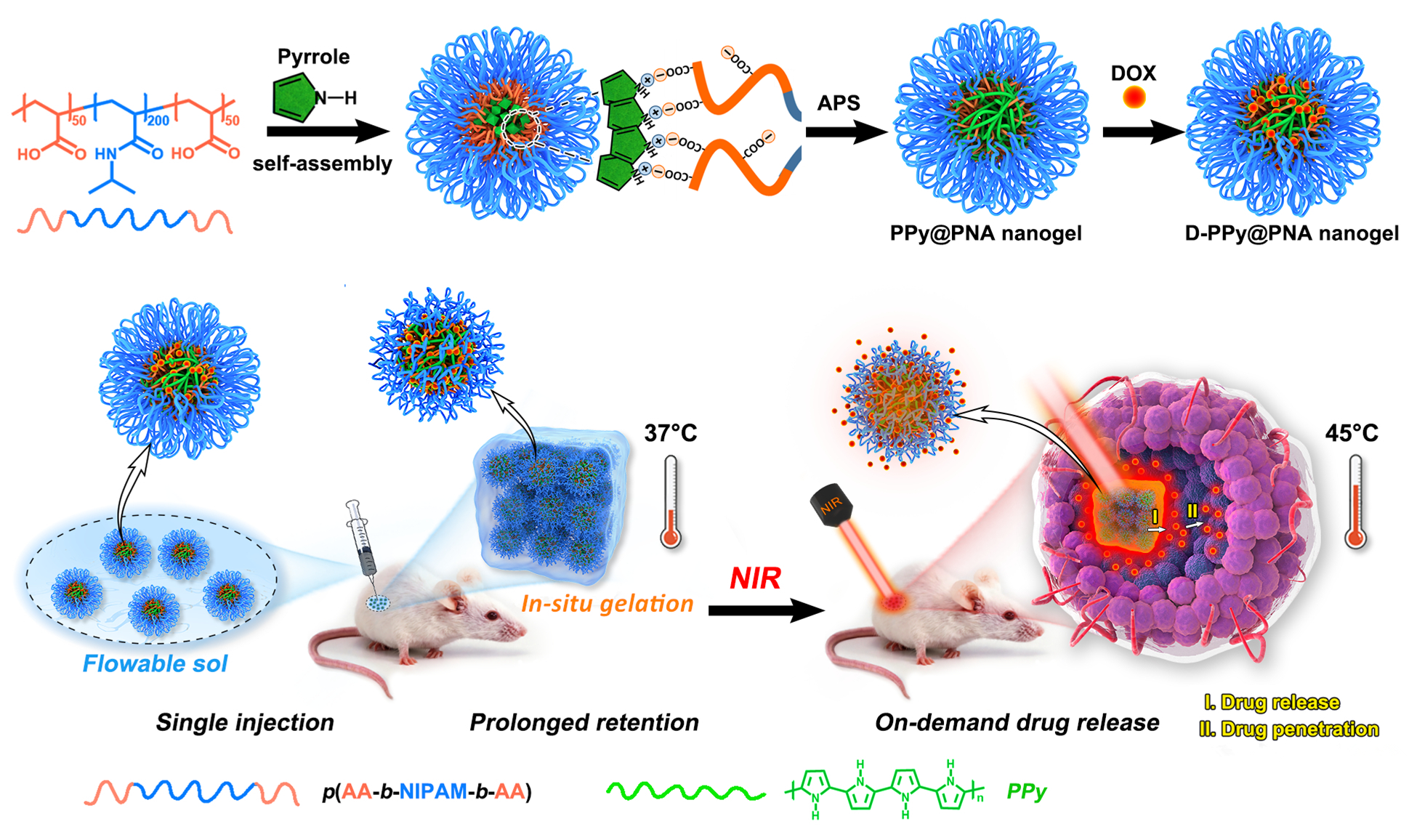
該課題組在之前的工作基礎之上,以三嵌段溫敏聚合物(聚丙烯酸-聚N-異丙基丙烯酰胺-聚丙烯酸,PNA)作為聚吡咯氧化聚合的穩定劑,通過一步法合成了溫敏聚吡咯納米凝膠(PPy@PNA),該納米凝膠表現出良好的生物相容性、膠體穩定性、光熱轉化效率和溫敏溶膠-凝膠相變行為。由于PNA聚合物鏈的羧基與化療藥物阿霉素之間的離子作用以及聚吡咯共軛骨架與阿霉素之間的π-π堆積作用,溫敏聚吡咯凝膠表現出高載藥量和可控/緩釋的特性,此外,該溫敏凝膠藥物遞送載體(D-PPy@PNAs)在近紅外光輻照下表現出顯著的腫瘤細胞內藥物攝取增加和促進藥物腫瘤內滲透的特點。體外試驗和荷瘤動物模型抑瘤試驗結果均表明,該聚吡咯溫敏水凝膠具有顯著的光熱化療協同增強治療效果,為探索新的腫瘤協同治療策略提供了一種新思路。
以上成果發表在ACS Applied Materials & Interfaces (ACS Appl. Mater. Interfaces 2020, DOI:10.1021/acsami.9b22654)上。華中科技大學生命科學與技術學院博士生耿石楠與趙浩為該論文的共同第一作者,生命科學與技術學院占桂婷博士參與了該項研究。趙彥兵教授和楊祥良教授為通訊作者。該研究得到國家重點研究計劃(2018YFA0208903,2015CB931800)和國家自然科學基金(81673016, 81773653,81627901, 81873917, 81571782)的資助。
- 浙江大學團隊 Adv. Sci.:可控自調節HIF-1α穩定劑釋放的溫敏水凝膠用于心肌梗死治療 2024-10-06
- 浙工大潘梅蘭教授團隊 Mater. Horiz.:一種新型手性分離方法 - 仿生溫敏凝膠膜 2024-09-27
- 首都醫科大學附屬北京友誼醫院柳柯教授、清華大學尹斕教授 ACS Nano:中耳遞送載藥水凝膠 - 一針治愈噪聲性聾 2024-02-14
- 中山大學吳丁財/黃榕康/鄭冰娜/王輝團隊 Adv. Mater.:具有長駐留性的可注射多孔炭納米酶水凝膠實現腫瘤的協同治療 2025-07-04
- 山東大學劉新宇、崔基煒教授交叉團隊 ACS Nano:靶向遞送與肝-骨軸調控協同治療骨質疏松 2025-06-29
- 港中深唐本忠院士、華科大羅亮教授/李忠安教授 ACS Nano:分子共組裝調控多陽離子光敏劑的聚集態實現腫瘤光熱-化療高效協同治療 2025-03-13
