致病微生物與宿主細胞之間的斗爭對人類的疾病或健康狀況起關鍵作用。全球范圍內由于抗生素濫用和耐藥病原體的增加,細菌感染仍然是人們健康的主要威脅。為了防止抗生素的不利影響,出現了諸如光熱和磁熱等熱消融療法的替代策略來抑制細菌感染,但熱消融過程中靶部位周圍產生的過多熱量通常會破壞宿主細胞并延長愈合時間,導致無法正常愈合。近來,新加坡南洋理工大學陳曉東教授、南京醫科大學胡本慧教授與美國斯坦福大學Reinhold H. Dauskardt、美國西北大學Teri W. Odom、廈門大學吳云龍、新加坡國立大學Chwee Teck Lim等課題組深度合作,報道了一種基于TRIM(熱干擾界面誘導緩解)效應的局部熱管理策略,從而為熱消融療法賦予‘剪枝’功能:選擇性殺滅細菌并最大程度地減少宿主細胞間內聚力(intercellular cohesion)損失,從而實現精確的抗菌治療。相關成果于2月19日在線發表于《Advanced Materials》。
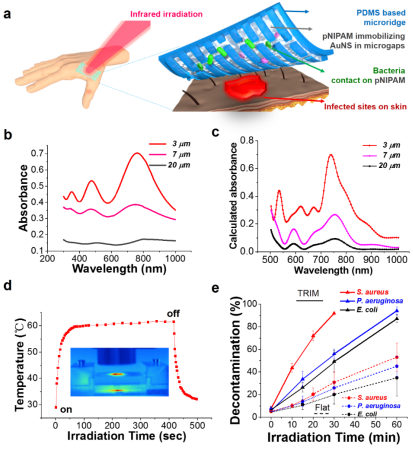
圖1:為熱消融療法賦予‘剪枝’功能用以高效選擇性抗菌
研究團隊制備的TRIM敷料膜由熱響應水凝膠區和機械支撐區按仿生結構微尺度化之后排列組成,并且區域埋覆了光熱轉化納米粒子,由此產生的生物界面的動態微形貌可在紅外輻射下干擾細菌定植并提升滅菌效率。在以適度的紅外輻射強度(70 mW / cm2)進行輻射后,熱響應微區會收縮呈現‘微谷’形貌,并將光熱轉化物質限域在微谷中,從而使熱量集中在細菌附近。微區空間分布使宿主細胞的受熱保持在安全閾值內,并迫使細菌處于單分散狀態進而更有效地被殺滅。在離體的人類表皮組織上的力學生物學(mechanobiology)研究進一步證明,具有關鍵形貌特征的薄膜可以顯著減少紅外輻射過程中的細胞間內聚力的損失,這表明了響應型微形貌對熱治療中維持皮膚機械完整性(mechanical integrity)和皮膚屏障功能的貢獻。在耐藥金黃葡萄球菌感染的小鼠中的在體研究表明,具有 TRIM效應的熱響應傷口敷膜可有效降低副作用、消除感染并促進傷口愈合。該研究實現了針對細菌感染的無抗生素治療,并證明了臨床敷料的轉化潛力,對抗菌療法的未來生物界面設計具有啟示作用。
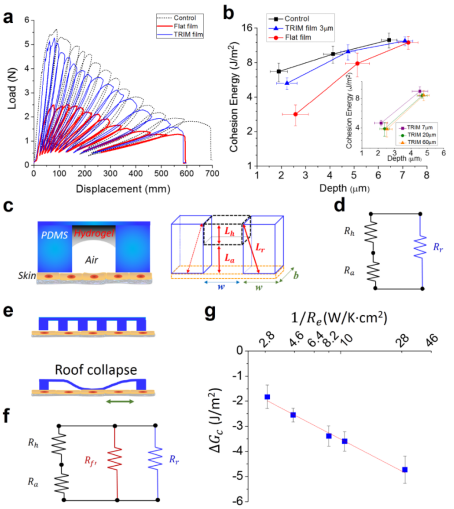
圖2:生物力學表征驗證TRIM效應:熱響應微結構顯著降低了光熱治療中表皮細胞間內聚力的損失
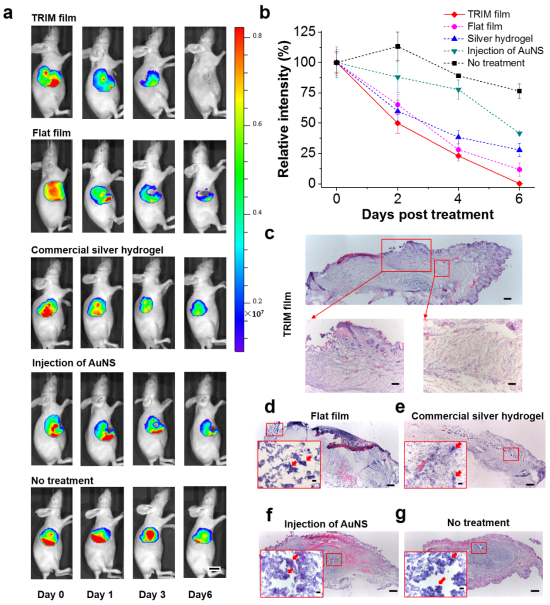
圖3:對耐藥菌感染的小鼠進行不同治療策略的體內評估
論文鏈接:Benhui Hu, et al. Thermal‐Disrupting Interface Mitigates Intercellular Cohesion Loss for Accurate Topical Antibacterial Therapy, Adv. Mater., 2020.DOI: 10.1002/adma.201907030
- 東華大學熊佳慶/周欣然 Adv. Mater.:光熱響應氣凝膠-水凝膠二元仿生體系實現全天候水伏發電 2025-05-21
- 東北林業大學劉守新教授團隊《Mater. Horiz.》:機械和熱響應的纖維素手性光子水凝膠用于動態防偽與光子皮膚 2025-01-26
- 華南理工大學江賽華教授課題組 JMCA:基于熱響應性膽甾相液晶彈性體的機器視覺表面溫度監測 2025-01-13
- 浙大王征科課題組《Macromol. Rapid Commun.》: 泥鰍粘液-甲基丙烯酰化明膠超潤滑水凝膠 2025-06-30
- 西交大魏釗/北大楊根 Small 綜述: 力學性能可調動態水凝膠用于3D類器官培養 2025-06-27
- 華科大吳豪等 Sci. Adv.:可重復使用柔性電子系統用于醫療健康監測 2025-06-26
