盡管納米載藥系統有助于提高藥物的溶解性和穩定性、改善藥物的循環時間和靶向性、降低藥物的毒副作用,納米藥物通過靜脈給藥時不可避免的面臨多重生物屏障,如血液屏障、組織屏障和細胞屏障等,導致其在臨床試驗中收益甚微。內源性細胞具備天然的遞送優勢,如長循環能力、自然的隱身性能以及定向遞送能力等,有望攜同納米載藥系統共同克服各種生物屏障,提高藥物的生物利用度。中科大王育才教授課題組曾提出利用中性粒細胞對細菌的特異性識別,使用細菌外膜囊泡實現對循環中性粒細胞的高效劫持。并利用微光熱處理腫瘤組織觸發局部炎癥微環境誘導中性粒細胞的浸潤,實現了細菌外膜囊泡包裹的納米藥物的高效遞送,從而徹底的清除殘留的腫瘤細胞,抑制了腫瘤復發[1]。
然而,納米藥物經靜脈注射后,會在其表面被動的吸附上一層血漿蛋白質,形成蛋白質冠。蛋白質冠的形成會屏蔽納米藥物表面配體的靶向作用,甚至導致表面修飾被降解,進而限制了納米藥物與內源性細胞的特異性結合。在前期的研究基礎上,該課題組提出通過調控載體特性實現對其表面蛋白質冠的主動精準調控,并利用蛋白質冠實現內源性中性粒細胞的劫持,進而利用中性粒細胞的天然遞送優勢實現納米藥物的高效遞送(圖1)[2]。

圖1.反轉脂質體主動誘導補體蛋白吸附用于靶向活化的中性粒細胞實現藥物高效遞送。
為了評估納米載體表面特性對中性粒細胞靶向的影響,作者篩選了不同表面特性的脂質體,所含脂質的疏水尾部一致,而親水頭部的化學結構和電性不同。通過流式細胞術和活體顯微成像實時觀察證明頭部反轉的脂質體(n-DOCPs)能夠特異高效地靶向血液中活化的中性粒細胞(圖2)。
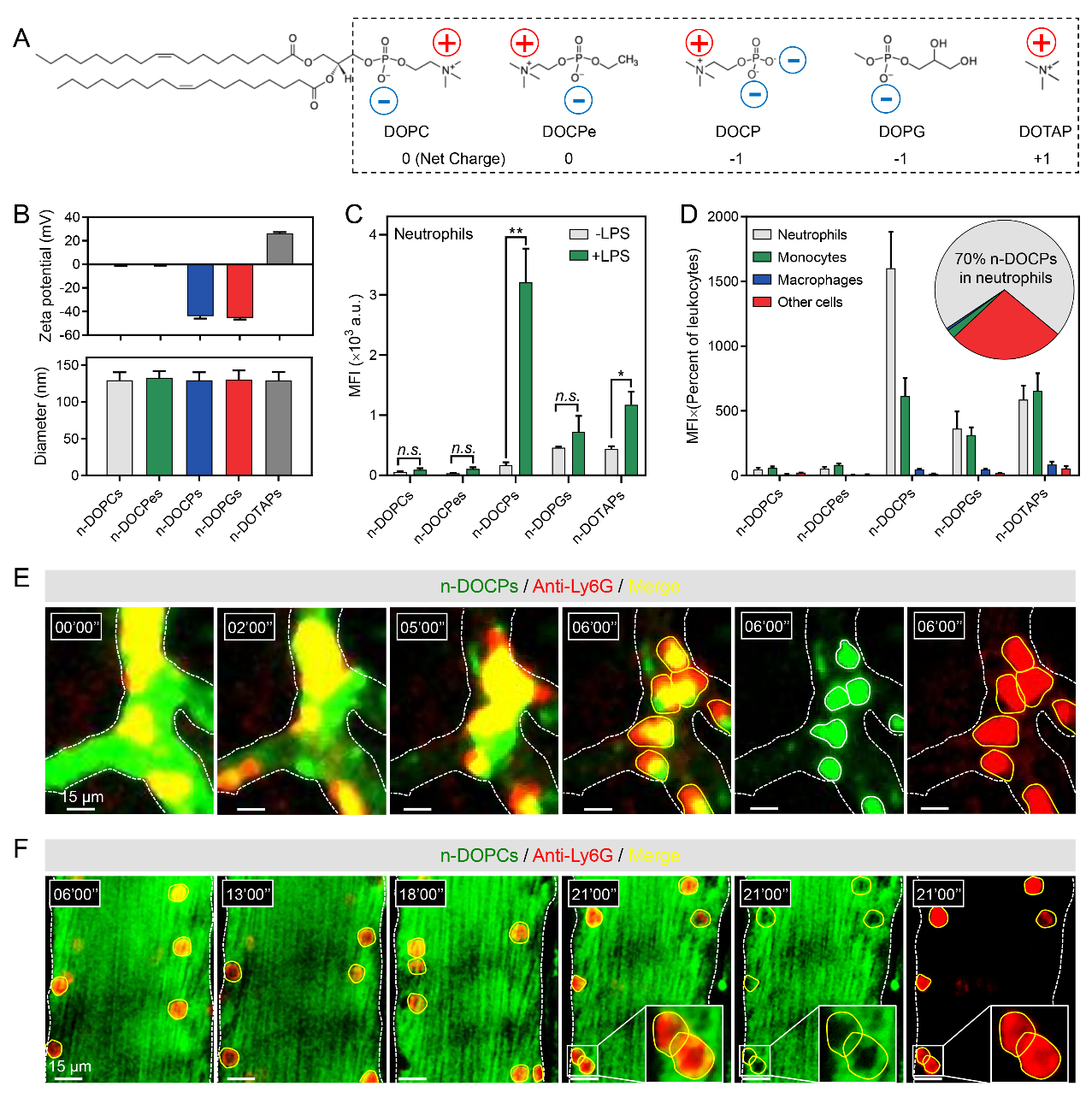
圖2.反轉脂質體靶向活化中性粒細胞。
作者接著探究反轉脂質體高效靶向活化中性粒細胞的機制,發現中性粒細胞的活化狀態和納米載體表面蛋白質冠的組成直接影響了納米載體與中性粒細胞的親和力(圖3)。證明了反轉脂質體在血液環境中能夠自發的激活補體調理作用,誘導形成富含補體片段iC3b的蛋白冠。該補體片段能夠特異的與中性粒細胞表面補體受體CR3相互識別和結合,誘導中性粒細胞的吞噬作用。此外,活化的中性粒細胞會高表達CR3,從而提高了反轉脂質體的靶向特異性。據此證明通過調控納米載體表面特性能夠改變蛋白質冠的組成從而實現對特定細胞的親和力。

圖3.蛋白質冠介導反轉脂質體靶向活化中性粒細胞。
其次,作者考察了中性粒細胞攜載納米藥物能否克服生理屏障實現納米藥物的病灶富集,以及胞內納米藥物如果在病灶部位發揮功效(圖4)。由于肺組織存在肺泡毛細血管屏障,納米藥物只有突破該屏障才能在病灶部位富集,通過活體顯微成像的實時追蹤觀察、流式細胞術分析、以及小動物成像儀檢測證明中性粒胞能夠利用其炎癥趨化作用將納米藥物遞送到炎性肺實質中。在病灶部位,中性粒細胞應答炎癥刺激形成細胞外捕獲網實現納米藥物的釋放。此外,胞內菌是克服細菌耐藥的難題,該體系證明攜載納米藥物的中性粒細胞不僅能夠釋放藥物,還能作為細胞反應器,將細菌吞入胞內,利用胞內高濃度的藥物進行細菌的殺傷作用。

圖4.中性粒細胞攜載納米藥物克服肺泡毛細血管障礙并發揮功效。
作者利用反轉脂質體包載糖皮質激素地塞米松進行靜脈注射給藥,有效的緩解了急性肺損傷小鼠的肺炎狀況。在臨床分離的肺炎鏈球菌誘導的小鼠肺炎模型中,通過注射包載氨芐青霉素的反轉脂質體,有效的控制了細菌的增殖,抑制了肺炎的爆發,并延長了細菌性肺炎小鼠的生存期(圖5)。利用納米藥物在給藥過程中自發形成的蛋白冠實現對循環細胞的靶向作用,以增強納米藥物的遞送,這一策略可能為新型藥物遞送系統的開發帶來新的機遇。
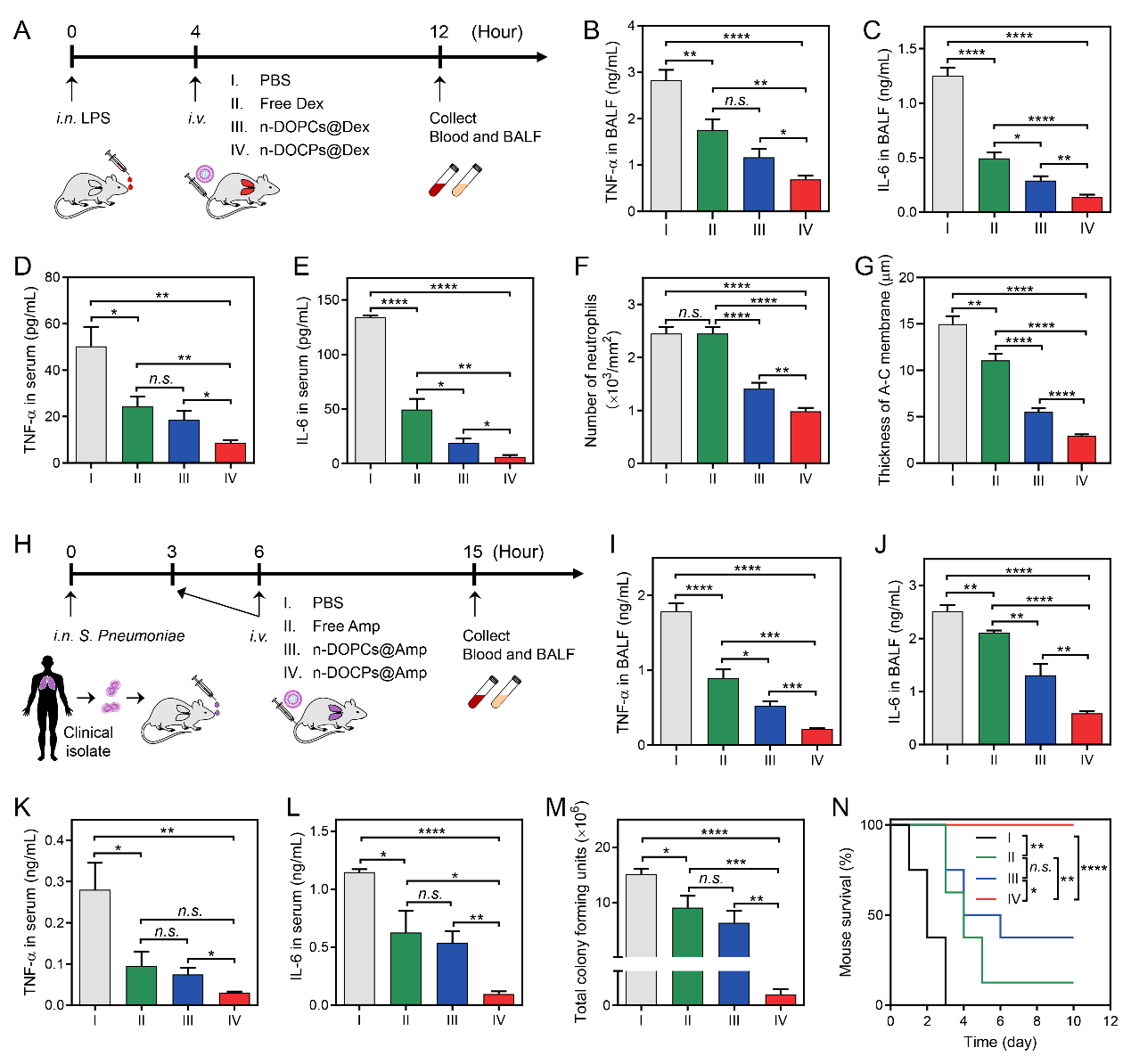
圖5.中性粒細胞攜載納米藥物減緩急性肺損傷和細菌性肺炎。
該研究工作近期發表于Advanced Materials。中國科學技術大學李舒雅博士和李敏博士為文章共同第一作者,中國科學技術大學王育才教授和華南理工大學王均教授為文章通訊作者。
參考文獻
[1] Li, M., Li, S.Y., Zhou, H., Tang, X.F., Wu, Y., Jiang, W., Tian, Z.G., Zhou, X.C., Yang, X.Z., Wang, Y.C., Chemotaxis-driven delivery of nano-pathogenoids for complete eradication of tumors post-phototherapy. Nature Communications, 2020, 11(1), 1126.
[2] Li, S.Y., Li M., Huo, S.H., Wang, Q., Chen, J., Ding, S.G., Zeng, Z.T., Zhou, W.C., Wang, Y.C., Wang, J., Voluntary-Opsonization-enabled Precision Nanomedicines for Inflammation Treatment. Advanced Materials, 2020, Dec 9, e2006160. doi: 10.1002/adma.202006160. Epub ahead of print. PMID: 33296121.
下載:原文
- 西北大學范代娣教授、朱晨輝教授、李陽副教授 AM:基于仿生凝血級聯途徑的多肽修飾脂質體納米顆粒可噴涂水凝膠治療不可壓破性創面出血 2025-04-19
- 天津大學史志遠教授團隊招聘科研助理 - 高分子化學、微凝膠/微囊泡/脂質體、酶包裹遞送載體、微流控 2024-12-17
- 桂工甄士杰/李美靜博士、廣醫張天富副教授、華工趙祖金教授、港中深唐本忠院士 AM:近紅外二區脂質體多模態光診療新成果 2024-11-29
- 中科大王育才/蔣為團隊 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破腫瘤血管基底膜屏障,增強納米藥物瘤內遞送 2025-05-03
- 川大李旭東/陳君澤、港城大譚超良團隊 Adv. Mater.: 多酚-氨基酸縮合物庫用于超高載藥量納米藥物的高通量連續流生產 2025-02-12
- 天工大高輝/李曉暉團隊 Acta Biomater.:二甲雙胍多功能納米藥物克服具核梭桿菌介導的結直腸癌化療耐藥與免疫抑制 2025-02-11
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
