細菌可以附著在植入的醫(yī)療設(shè)備上形成生物膜,從而導(dǎo)致持續(xù)感染甚至患者死亡,對公眾健康造成嚴(yán)重威脅。現(xiàn)有對抗生物膜的最常見方法是增加抗生素的使用劑量。然而,過度使用抗生素會導(dǎo)致耐藥菌的產(chǎn)生。因此,開發(fā)一種生物膜敏感的新型生物膜殺傷策略迫在眉睫。
光動力療法(PDT)在治療細菌引起的生物膜感染方面具有巨大的應(yīng)用潛力。但是革蘭氏陰性菌的外膜和帶高負電荷的脂質(zhì)部分阻礙了光敏劑與細菌的有效結(jié)合,這導(dǎo)致了PDT對革蘭氏陰性菌的殺傷效率不高。現(xiàn)有的解決方法是將PS與陽離子聚合物或陽離子抗菌肽相結(jié)合。陽離子光活性納米粒子(NPs)通過與的細菌結(jié)合,不僅可以提高革蘭氏陰性菌對PDT的敏感性,還可以增強生物膜滲透和根除。然而,帶正電荷的納米顆粒對正常的哺乳動物細胞存在潛在毒性。
針對正電荷納米顆粒存在的潛在毒性,徐福建教授團隊引入了pH響應(yīng)的概念,如圖1所示,以電荷逆轉(zhuǎn)為策略設(shè)計了具有低細胞毒性和高抗菌活性的功能適應(yīng)性納米顆粒RB@PMB@GA NPs。RB@PMB@GA NPs在生理條件下(pH 7.4)是負電性的,減少了細胞內(nèi)吞,對正常細胞的毒性最小。由于細菌代謝物的存在,感染部位通常是酸性微環(huán)境,pH范圍為5.0 - 6.5。RB@PMB@GA NPs在酸性相關(guān)感染部位由于質(zhì)子作用使得葡萄糖酸(GA)脫落,轉(zhuǎn)換為正電性的納米顆粒RB@PMB NPs,可以有效地結(jié)合到帶負電的細菌表面,從而增強了對革蘭氏陰性菌的光動力抗菌作用。
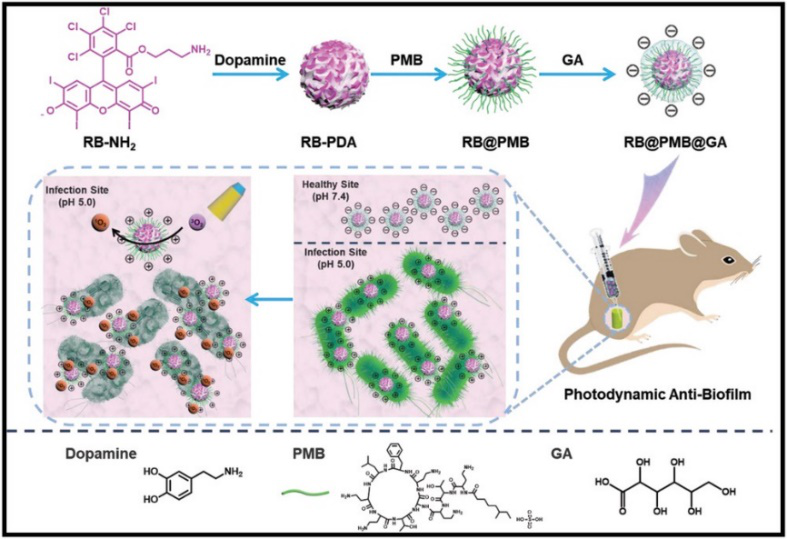
圖1. 用于增強生物膜滲透和抗菌效率的光動力納米顆粒的制備過程示意圖。
本研究首先選擇了革蘭氏陰性菌(大腸桿菌,紅色)和革蘭氏陽性菌(金黃色葡萄球菌,黃色)來測試RB@PMB@GA NPs的光動力抗菌能力。圖2的結(jié)果表明,相對于革蘭氏陽性菌,革蘭氏陰性菌比PDT更不敏感。但是在酸性環(huán)境下,RB@PMB@GA NPs 的電荷反轉(zhuǎn)能力提高了它們對革蘭氏陰性菌的功效。
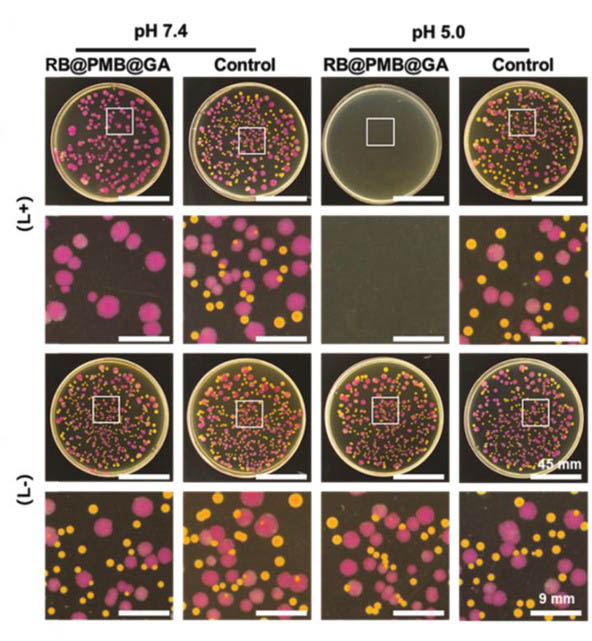
圖2. RB@PMB@GA NPs在pH 7.4和pH 5.0條件下對大腸桿菌和的金黃色葡萄球菌的抗菌測試。
此外,本研究進一步檢測了RB@PMB@GA NPs對生物膜的滲透殺傷性能。如圖3所示,在7.4和5.0的pH值下RB@PMB NPs能有效滲透到生物膜內(nèi)。然而,在pH 7.4的生物膜中僅檢測到 RB@PMB@GA NPs 的非常微弱的紅色熒光,在pH 5.0時RB@PMB@GA NPs能滲透到生物膜底部。因為 RB@PMB@GA NPs在酸性微環(huán)境脫落GA帶正電,與帶負電細菌表面發(fā)生靜電相互作用而迅速滲入生物膜并根除生物膜。這些結(jié)果也通過在體內(nèi)小鼠模型中植入導(dǎo)管得到了證明,這為消除醫(yī)療器械上的生物膜提供了一種很有前景的方法。

圖3. 在不同pH值下用RB@PMB和RB@PMB@GA NPs處理的銅綠假單胞菌生物膜的CLSM圖像。
最后,該團隊選擇植入的導(dǎo)管小鼠模型來證明RB@PMB@GA NPs在體內(nèi)感染微環(huán)境激活的光動力抗菌效率。圖4結(jié)果證實了RB@PMB@GA NPs光照情況下在體內(nèi)具有良好的生物膜消除能力。

圖4. a)第1、3和7天不同處理下小鼠的切口區(qū)域和植入導(dǎo)管的典型照片。b)從組織和導(dǎo)管中獲得的細菌菌落的定量分析。
以上相關(guān)成果發(fā)表在Adv. Funct. Mater.2021, 2103591。論文的第一作者為北京化工大學(xué)材料科學(xué)與工程學(xué)院碩士研究生吳雙梅,通訊作者為北京化工大學(xué)的徐福建教授和俞丙然教授,北京大學(xué)口腔醫(yī)學(xué)院王宇光副教授。
論文鏈接:https://pericles.periclesprod.literatumonline.com/doi/full/10.1002/adfm.202103591
- 東北林大劉守新教授團隊《Adv. Sci.》:纖維素/木質(zhì)素基陽極的彈性形變恢復(fù)老化的混合培養(yǎng)電活性生物膜 2025-05-15
- 四川大學(xué)鄧怡團隊《ACS Nano》:多功能納米生物異質(zhì)結(jié)復(fù)合水凝膠敷料 - 用于傷口細菌生物膜感染的診療一體化新策略 2025-03-15
- 港中大張立教授團隊《Sci. Adv.》:液態(tài)機器人清除復(fù)雜表面細菌生物膜 2025-03-15
- 西南大學(xué)康燕堂/徐立群/徐琨 Adv. Mater.:空心普魯士藍納米框架仿生增強梯度抗菌涂層 2025-07-01
- 蘇大李剛、附一院李峰和附四院沈罡 IJBM: 兼具抗菌和抗狹窄功能的載藥可降解輸尿管支架 2025-06-29
- 青島大學(xué)于冰教授團隊 Small:具有快速止血和廣譜抗菌特性的寡肽水凝膠用于加速傷口愈合 2025-06-03
- 南華大學(xué)魏華/喻翠云教授團隊 CEJ:超分子納米自組裝體介導(dǎo)的GSH耗竭促進協(xié)同化療和光動力療法的免疫原性增強 2023-05-28
