由于發病率和死亡率的不斷上升,癌癥已經成為全世界威脅人類健康的最常見疾病。現有的多種抗腫瘤治療方法,包括手術切除、化療、放療等,盡管加大了治療力度,但治療后癌癥復發和死亡的數量仍然很高。目前納米載體介導的光療法,包括光動力療法 (PDT) 和光熱療法 (PTT),由于其無侵入性、高選擇性、不良反應小等優點,在過去十年中被廣泛開發,成為最有前途的治療方法之一。但無論是PTT或者PDT都有其不可避免的缺陷,因此,許多關于合理治療策略的工作從單一治療發展到PDT和PTT聯合治療。PDT可以利用活性氧消除PTT過程中的熱休克蛋白,提高光熱效應。相反,PTT可以利用熱能激發腫瘤細胞的分子運動,提高周圍腫瘤細胞的氧水平,從而緩解PDT的氧依賴問題,增強其作用。目前,這種策略的大多數往往是相對復雜的,且通常需要兩種或兩種以上的激光,極大地阻礙了進一步的臨床應用。通過單一組分物質既實現單組分系統,又實現單波長激光照射,同時保持最大的PTT/PDT協同治療效果,在生物醫學領域引起了廣泛關注。
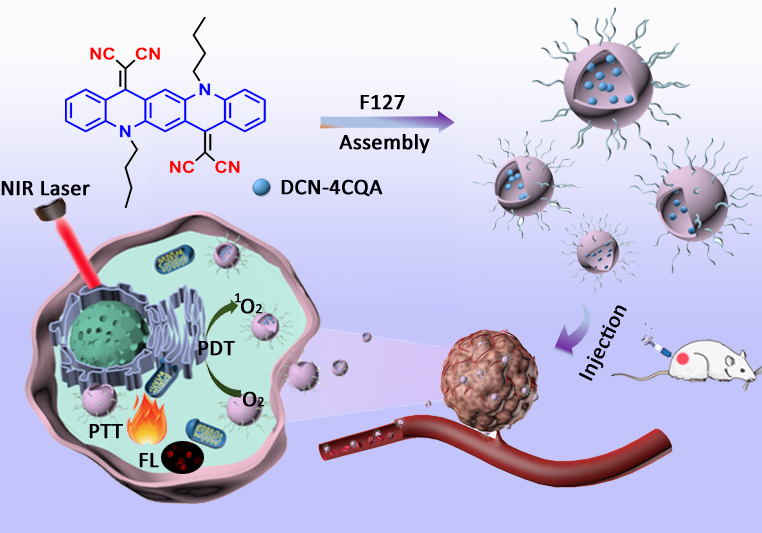
圖1分子結構,納米材料制備和多功能光治療的應用示意圖。
近日,東北林業大學化學化工與資源利用學院賈濤副教授、趙修華教授團隊構建了一種單一分子應用于PTT/PDT協同治療。該研究以經典的有機光電材料喹吖啶酮 (QA) 為原料,通過簡單的合成方法,獲得了具有雙功能光療和近紅外熒光特性的診斷和治療用 “一體化” 功能材料二氰取代5,12-二丁基喹吖啶酮 (DCN-4CQA)。在4CQA上修飾較強的吸電子-CN基團,增強其分子內電子轉移特征,使吸收帶進一步向近紅外區移動。以Pluronic®127 (F127) 為載體制備了智能水溶性納米粒子DCN-4CQA/F127,所制備的納米粒子不僅很好地保留了小分子優異的性能且在近紅外激光照射下具有良好的生物相容性、良好的光穩定性、高的光熱轉換效率 (η = 47.3%) 和足夠的1O2生成 (ΦΔ = 24.3%)。在實現安全、高效、準確的癌癥治療方面具有良好的應用潛力。
體外實驗結果表明,所制備的納米粒子(DCN-4CQA/F27 NPs)具有良好的光熱性能以及光熱穩定性,且具有較低的暗毒性,但在655 nm激光照射下,DCN-4CQA/F27 NPs在產熱的同時仍能夠繼續產生較強的單線態氧,通過良好的協同作用殺死癌細胞。此外,該納米粒子還具有一定的熒光成像的能力,靜脈注射一段時間后,根據熒光追蹤可以判斷其從肝臟及腎臟排出。體內抗腫瘤實驗顯示,通過瘤內注射DCN-4CQA/F27 NPs后,可以觀察到明顯的抑瘤效果。在15天治療周期內基本能達到完全抑制腫瘤效果。繼續觀察治療過程中小鼠體重的變化。所有組的小鼠體重均能夠保持平穩。在結束治療后,采用H&E染色法,以探究DCN-4CQA/F27 NPs潛在的小鼠體內毒性。所有治療組的主要器官均未出現明顯的病理異常,表明該納米粒子無明顯的全身毒性。

圖2 (A-C)DCN-4CQA/F27 NPs光熱及光穩定性;(D)DCN-4CQA的ESR信號;(E,F)DCN-4CQA/F27 NPs體內熒光信號。
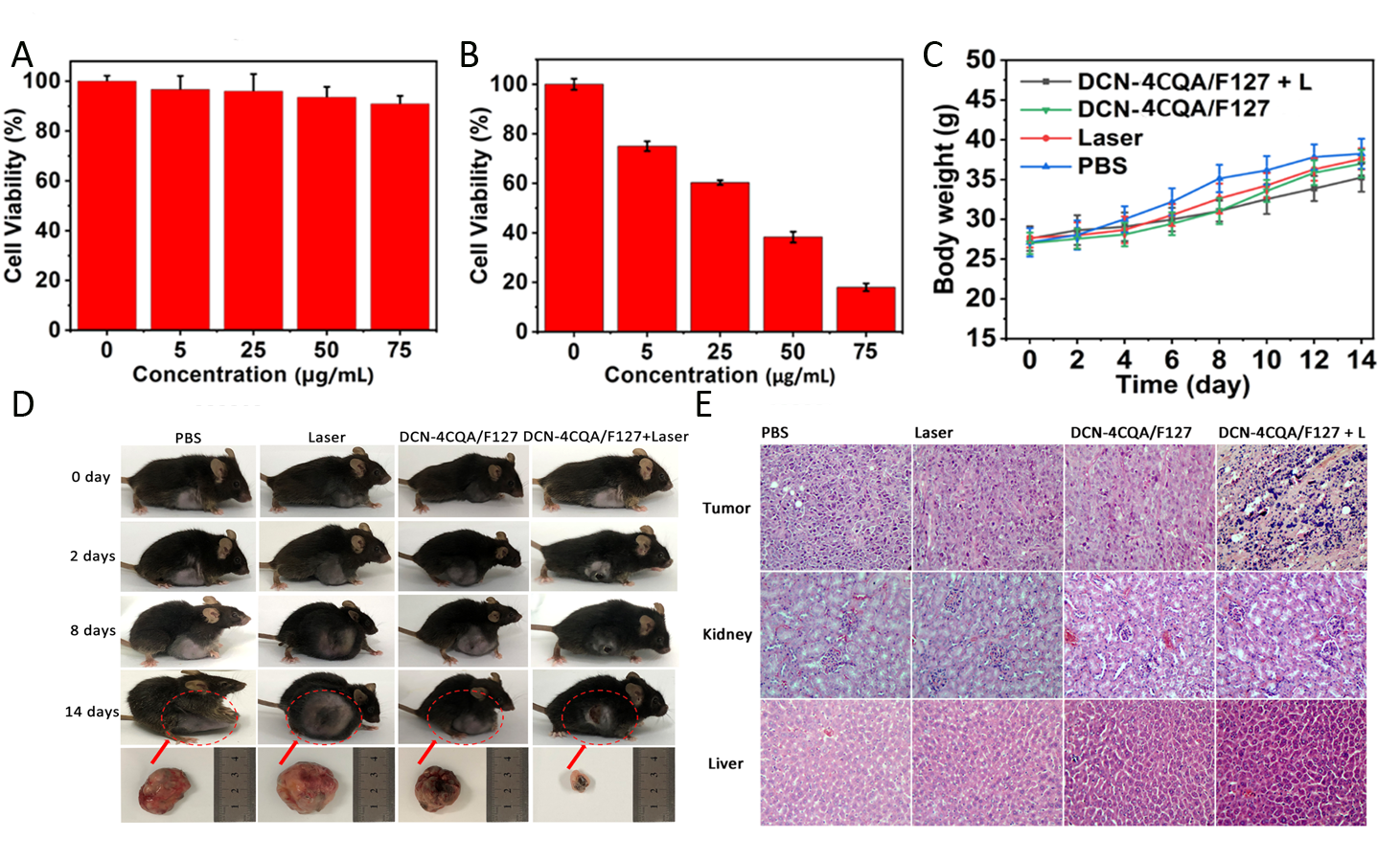
圖3 (A,B)HeLa細胞在黑暗及光照下相對活性;(C)小鼠體重;(D)監測小鼠腫瘤生長;(E)H&E組織切片。
綜上所述,所有結果證明了所提出的多功能近紅外有機小分子設計的可行性,這種基于單一分子制備的功能性納米粒子的PTT/PDT協同治療具有理想的腫瘤殺傷性能,并取得了最大限度的治療效果。該研究為設計近紅外有機小分子提供了一種可行的策略,為進一步開發高性能有機治療劑提供了新的思路。
相關研究成果"All-in-One" Strategy Based on Organic Molecule DCN-4CQA for Effective NIR Fluorescence Imaging guided Dual Phototherapy”近期發表在Journal of Materials Chemistry B (IF=6.331),該論文被編輯重點評述,并邀請期刊封面。通訊作者為東北林業大學賈濤副教授和趙修華教授,碩士研究生李露為論文的第一作者。該工作得到了黑龍江省杰出青年基金、黑龍江省留學回國人員擇優資助、中國博士后基金和黑龍江省頭雁計劃研究經費的資助。最后特別感謝吉林大學超分子結構與材料國家重點實驗室王悅教授的悉心指導。
論文鏈接:https://pubs.rsc.org/en/content/articlelanding/2021/tb/d1tb00949d#!divAbstract
- 南華大學魏華/喻翠云教授團隊 CEJ:超分子納米自組裝體介導的GSH耗竭促進協同化療和光動力療法的免疫原性增強 2023-05-28
- 天津工業大學林佳弘特聘教授/李婷婷副教授課題組《Chem. Eng. J》綜述:基于光動力療法的協同抗菌策略 - 進展與展望 2022-09-03
- 華南理工唐本忠院士團隊馮光雪教授、秦安軍教授合作《ACS Nano》:一種通用的陽離子化分子工程策略用于光動力治療細菌感染 2022-06-07
- 唐本忠院士/徐峰教授團隊/鄭磊教授團隊合作AM:是“金子”,不僅能增強AIEgen發光,還能提升光療 2023-07-29
- 中科院化學所肖海華研究員團隊《Adv. Mater.》:可降解的近紅外二區假性共軛聚合物光熱劑治療高級別漿液性卵巢癌 2021-12-01
- 中科大王育才教授/白麗教授合作Nano Letters:高分子材料增強自然殺傷性T細胞的腫瘤治療效果 2021-07-21
- 山東大學劉新宇、崔基煒教授交叉團隊 ACS Nano:靶向遞送與肝-骨軸調控協同治療骨質疏松 2025-06-29
