生物材料的快速發(fā)展,為更加安全、有效地治療各類血管疾病,提供了新的工具。理想的血管支架材料,應(yīng)支持血管內(nèi)皮細胞在其表面粘附、鋪展、并實現(xiàn)全面覆蓋(“內(nèi)皮化”),從而避免異物誘發(fā)血栓或血管堵塞。傳統(tǒng)的材料,要么支持內(nèi)皮細胞粘附效果不佳;要么是在對其表面修飾粘附“信號”(如可結(jié)合細胞整合素受體的肽段)后,提高了其促進內(nèi)皮細胞生長的能力,但這些信號也同時支持其他類型的細胞粘附。那么,有什么辦法可以選擇性地促進內(nèi)皮細胞在材料表面的鋪展呢?
澳門大學(xué)王春明和南京大學(xué)董磊合作,設(shè)計了一種基于全新機制促進內(nèi)皮化的多糖材料。他們注意到:當微生物(如真菌)感染機體時,須穿透內(nèi)皮細胞從而侵襲組織(transmigration)。在這一過程中,微生物表面的多糖分子發(fā)揮了先鋒作用,與內(nèi)皮細胞表面或分泌的多種可識別糖的受體建立連接,從而“搭橋”突破內(nèi)皮防線。這一特殊的機制為研究者帶來靈感:將這些糖分子“進攻”內(nèi)皮細胞時的獨特作用,轉(zhuǎn)變?yōu)橐龑?dǎo)內(nèi)皮細胞特異性粘附的親和能力,設(shè)計促進內(nèi)皮化的糖生物材料基質(zhì)(圖1)。
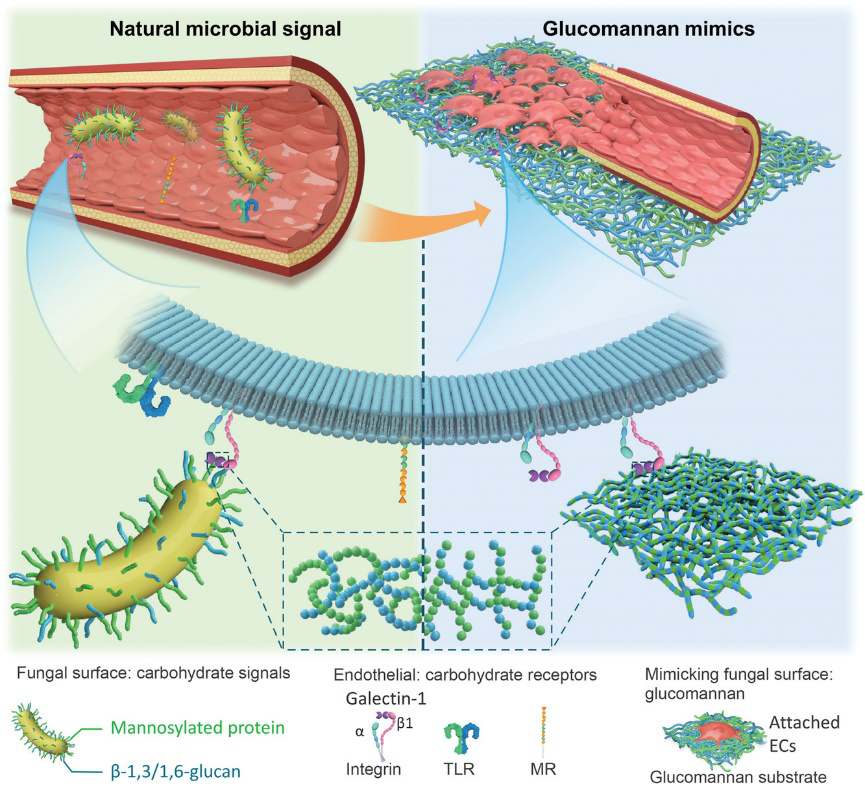
圖1. 受真菌侵染內(nèi)皮細胞啟發(fā),設(shè)計材料表面內(nèi)皮化的研究構(gòu)思。
然而,第一,微生物表面與這些受體結(jié)合的糖鏈異質(zhì)性高且難以大規(guī)模制備(就材料制備的量級來說);第二,多糖的水溶性使其不易加工成型。為解決這兩個問題,研究者篩選植物來源的葡甘聚糖,并進一步進行不同碳鏈長度的酯化增加分子的疏水性,在經(jīng)過分子模擬和點雜交實驗驗證后,獲得了一種葡甘聚糖的癸酸酯(簡稱GMDE),對于內(nèi)皮細胞分泌的Galectin蛋白具有選擇性親和能力。研究者進一步地將GMDE制備為薄膜材料和靜電紡絲纖維,發(fā)現(xiàn)相比于同系列的其他糖酯衍生物,具有明顯的促進內(nèi)皮細胞粘附的優(yōu)勢。有趣的是,研究者同時對比成骨細胞、上皮細胞、成纖維細胞、及平滑肌細胞,它們在GMDE材料表面的粘附程度都遠低于內(nèi)皮細胞,證明了GMDE選擇性支持內(nèi)皮細胞粘附的能力。

圖2. 不同類型的細胞,包括人(HUVEC)和鼠(SVEC4-10)內(nèi)皮細胞及其他組織細胞,在GMDE和其他葡甘聚糖衍生物上的粘附情況
可是,GMDE是如何通過與Galectin的親和來促進血管內(nèi)皮細胞的粘附呢?為了回答這個問題,研究者設(shè)計了一系列生物學(xué)實驗驗證機理。首先,他們對比了人和鼠多種細胞分泌或表達幾種主要糖受體或糖結(jié)合蛋白的豐度,發(fā)現(xiàn)內(nèi)皮細胞表達和分泌Galectin的能力都高于另幾種細胞。而且,相比于傳統(tǒng)聚己內(nèi)酯或玻璃材料,GMDE表面吸附Galectin的能力最強。進一步地,研究者觀察到內(nèi)皮細胞自身分泌的Galectin,以橋接的形式,一頭搭在GMDE表面,一頭銜接細胞表面的整合素b1受體(圖3)。此外,內(nèi)皮細胞的粘附,可被Galectin的競爭性抑制劑或整合素抗體破壞,從而證明了內(nèi)皮細胞與多糖材料,通過Galectin “搭橋”聯(lián)接這一獨特美妙的方式。

圖3. 粘附在GMDE纖維支架上的HUVEC細胞分泌Galectin-1和表達integrin染色
最后,研究者評估了GMDE纖維支架在小鼠下肢缺血模型中對于血管治療的潛力。他們通過將小鼠左下肢股深動脈結(jié)扎造成左下肢缺血,并保持右側(cè)下肢肌肉健康。在動脈結(jié)扎處植入GMDE靜電紡絲,聚己內(nèi)酯靜電紡絲作為對照,同時在結(jié)扎處注射PBS作為陰性對照,注射血管內(nèi)皮生長因子VEGF作為陽性對照。對所有實驗組進行為期28天的下肢血流灌注量的測定,研究者發(fā)現(xiàn)植入GMDE纖維支架后,缺血下肢血流灌注量高,緩解了因缺血導(dǎo)致的小腿肌肉壞死。而且通過CD31和α-SMA免疫熒光染色發(fā)現(xiàn)GMDE纖維支架可促進血管新生,且不會引起炎癥反應(yīng)。
該研究的材料設(shè)計思路新穎,既不修飾細胞粘附的肽段、也未添加外源性的促血管新生因子,而是基于糖分子與細胞受體的相互作用的生物化學(xué)機制,改善材料表面的內(nèi)皮細胞選擇性,可謂獨辟蹊徑,為相關(guān)生物材料的研發(fā)提供了與常規(guī)方法不同的思路。這一工作于2021年9月3日以A “Bridge-Building” Glycan Scaffold Mimicking Microbial Invasion for In Situ Endothelialization為題在線發(fā)表于Advanced Materials,澳門大學(xué)博士研究生母若雨和碩士研究生張鈺函為共同第一作者,研究得到國家自然科學(xué)基金委員會優(yōu)秀青年科學(xué)基金(港澳)、澳門科技發(fā)展基金的支持。
原文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202103490
- 北京大學(xué)邵元龍《Adv. Mater.》綜述:用于組織電子設(shè)備接口的生物材料基纖維狀植入式探針 2025-06-27
- 陳學(xué)思院士/田華雨教授/方華攀副教授 AHM:生物材料在腦部疾病中的機遇與挑戰(zhàn) 2025-06-08
- 武漢輕工大學(xué)朱鏈/未本美、湖北工程學(xué)院汪海波 Polym. Rev.: 膠原生物材料的最新進展 - 從提取、交聯(lián)到組織再生 2025-03-21
- 廣西大學(xué)林寶鳳教授 IJBM:XSBR介導(dǎo)的生物質(zhì)聚合物 - 一種解決天然多糖基薄膜低韌性和高親水性的新策略及在食品包裝中的應(yīng)用 2025-06-23
- 西北師范大學(xué)彭輝、馬國富教授團隊 ES&T: 讓空氣直接澆灌莊稼 2025-06-01
- 天大鄭俊萍、德州學(xué)院趙靜 Macromolecules:氫鍵增強多糖基凝膠實現(xiàn)高拉伸與裂紋擴展應(yīng)變 2025-05-22
- 大工王華楠教授團隊 AFM:仿生設(shè)計4D打印多步響應(yīng)Janus血管支架 2024-09-06
