基于split protein (拆分蛋白)的分子工具被應(yīng)用于生物信號的控制、高級生物分子結(jié)構(gòu)的設(shè)計等,但是諸多缺點,包括自發(fā)重組的不可控性,產(chǎn)物的不穩(wěn)定性以及缺乏動態(tài)多樣性等限制了此類工具更廣泛的應(yīng)用。香港科技大學(xué)孫飛課題組近期成功拆分光敏轉(zhuǎn)錄調(diào)節(jié)因子CarHC, 獲得一種新型的同時具有小分子(維生素B12)/光響應(yīng)能力的蛋白質(zhì)組裝工具split CarHC。這一新手段也催生了一系列具有可調(diào)機(jī)械性能的光敏水凝膠的設(shè)計研發(fā),可被應(yīng)用于三維細(xì)胞培養(yǎng)及細(xì)胞—細(xì)胞外基質(zhì)相互作用等研究。該工作以“B12-induced reassembly of split photoreceptor protein enables photoresponsive hydrogels with tunable mechanics” 為題發(fā)表于《Science Advances》雜志(2022.04.)。文章第一作者是香港科技大學(xué)楊中光博士,通訊作者為香港科技大學(xué)孫飛教授。
光敏蛋白CarH最早作為合成類胡蘿卜素基因的轉(zhuǎn)錄調(diào)節(jié)因子在細(xì)菌中被發(fā)現(xiàn)。其C端結(jié)構(gòu)域CarHC在黑暗中與腺苷鈷胺(AdoB12)結(jié)合后四聚,并在暴露于綠光或白光時重新解聚為單體(圖1)。細(xì)菌細(xì)胞利用這一過程控制CarH與類葫蘆卜素基因的結(jié)合程度從而操縱該基因的表達(dá)水平。CarHC的光敏和多聚特性促成了多種光遺傳學(xué)工具及光敏水凝膠材料的研發(fā)。
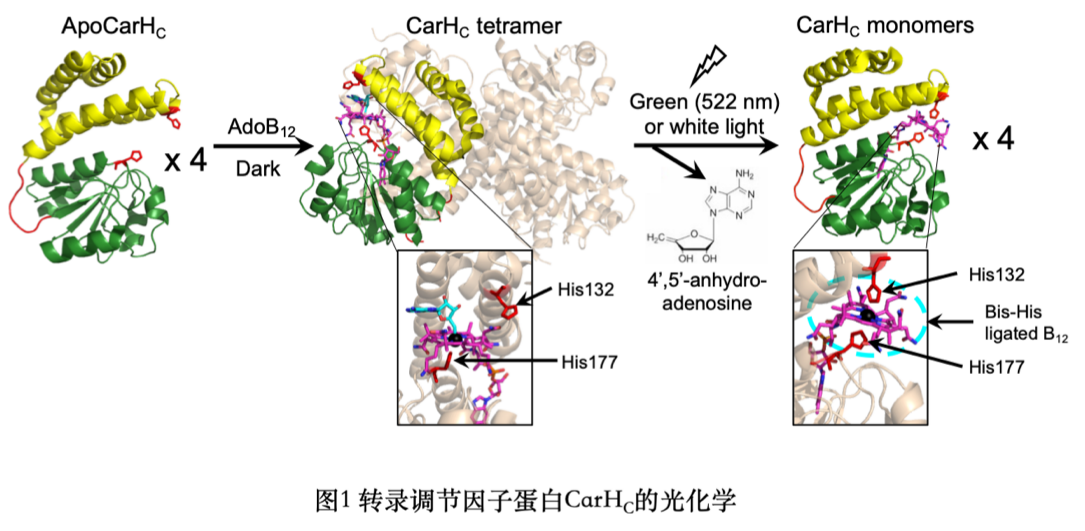
CarHC主要由一個四螺旋束(four helix bundle)結(jié)構(gòu)域和一個B12結(jié)合結(jié)構(gòu)域構(gòu)成,二者之間通過一段無結(jié)構(gòu)的多肽序列連接(圖2)。該工作將CarHC于此段無結(jié)構(gòu)的區(qū)域切分,并在體外利用大腸桿菌成功表達(dá)、純化兩個重組蛋白,即CarHCN和CarHCC(split CarHC)(圖2)。CarHCN和CarHCC在體外不會自發(fā)重組,當(dāng)與AdoB12結(jié)合后會重組并四聚;在暴露于白光后四聚體解聚為單體CarHC。由于分別來源于CarHCN、CarHCC的兩個組氨酸(His132和His177)和B12內(nèi)鈷離子形成的穩(wěn)定結(jié)構(gòu),光解后的單體CarHC不會進(jìn)一步解聚為CarHCN和CarHCC(圖3)。與AdoB12不同,甲鈷胺(MeB12)雖然也可以介導(dǎo)CarHCN與CarHCC的重組,但并不會引發(fā)四聚(圖3)。split CarHC與AdoB12/MeB12反應(yīng)的多樣性及魯棒性反映其在復(fù)雜生物體系內(nèi)進(jìn)行精準(zhǔn)信號控制的潛能。


除此之外,基于split CarHC結(jié)合AdoB12/MeB12后所展現(xiàn)出的兩種光響應(yīng)蛋白化學(xué)(圖3),以及自發(fā)形成共價鍵的Spy蛋白化學(xué),該工作設(shè)計合成了兩種光敏水凝膠材料——受光照后機(jī)械硬度降低的Ado膠和受光照后機(jī)械硬度增強的的Me膠 (圖4)。兩種水凝膠都被應(yīng)用于三維培養(yǎng)人間充質(zhì)干細(xì)胞(hMSCs)。鑒于與天然生物組織如骨髓(0.5-1.5千帕),脂肪(0.5-1.0千帕)和腦組織(0.1-1.0千帕)機(jī)械強度的相似性,這兩種光敏水凝膠也許可以被應(yīng)用于材料生物學(xué)和組織再生領(lǐng)域。
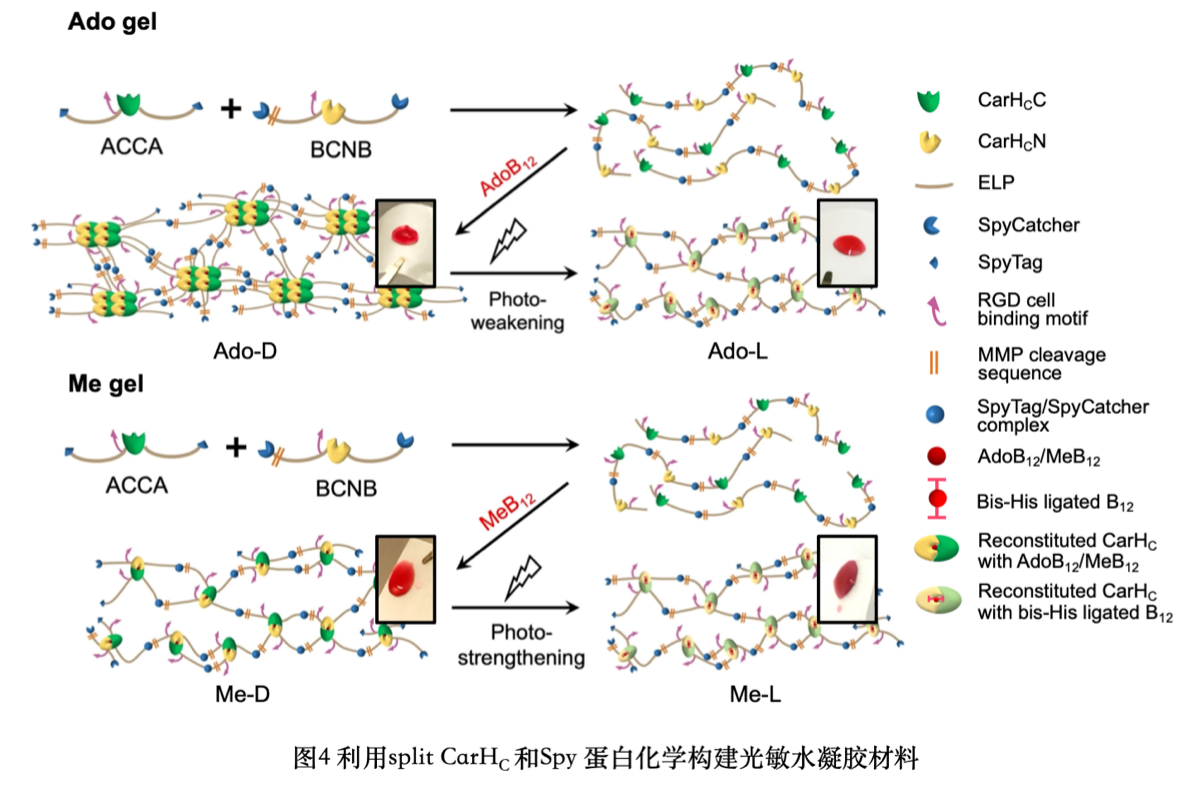
本文通過拆分細(xì)菌光感受蛋白CarH的 C 端結(jié)構(gòu)域,開發(fā)出一種同時響應(yīng)維生素B12/光的蛋白質(zhì)組裝分子工具,split CarHC。split CarHC具有極低背景重組,高穩(wěn)定性,高特異性及光可控性等優(yōu)點,可用于構(gòu)建具有動態(tài)機(jī)械性能的光響應(yīng)蛋白水凝膠,支持三維細(xì)胞培養(yǎng)。與此同時, split CarHC也有潛力成為一種新型控制體內(nèi)生物信號傳導(dǎo)的光遺傳學(xué)工具。
原文鏈接:https://doi.org/10.1126/sciadv.abm5482
