水凝膠組織粘合劑由于良好的生物相容性以及組織相似性在傷口敷料、組織修復、藥物傳遞、智能可穿戴電子設備等領域具有廣闊的應用前景。水凝膠實現有效界面粘接需要滿足兩個前提條件:一是水凝膠表面存在可以和粘附界面形成相互作用的官能團;二是水凝膠基體在外力作用下可以有效進行能量耗散。傳統水凝膠由于缺乏能量耗散機制或結構不均勻力學性能相對較差。為了提高水凝膠的能量耗散能力,近年來研究通過引入有效的可逆交聯點來增韌水凝膠,包括雙網絡水凝膠,納米復合水凝膠等。然而網絡交聯密度增加限制了高分子鏈運動,影響了與粘附界面的相互作用。因此,如何提高水凝膠基體韌性和界面作用強度之間協同作用進而實現有效界面粘接仍然存在挑戰。

針對以上問題,西安交大成一龍研究員課題組利用N-丙烯酰谷氨酸(AGLU)、 N-丙烯酰天冬氨酸(AASP)、 N-丙烯酰氨基丙二酸(AAMI)進行自由基聚合, 簡單快捷地發展了一系列全新的、基于氫鍵交聯網絡的水凝膠組織粘合劑,并系統研究了分子空間位阻對基體內聚能以及界面粘接強度的影響規律。由于α-碳原子和羧基之間亞甲基數目對空間位阻的影響,三種水凝膠中羧基的游離和締合狀態存在差異,其中聚(N-丙烯酰天冬氨酸)PAASP 水凝膠基體內聚能(氫鍵締合羧基)和界面粘接強度(界面游離羧基)實現協同作用,不僅具有優異的力學性能,而且表現出有效的組織粘接行為,滿足組織粘合劑的基本需求,具有進行緊急自救和組織修復的應用優勢。

圖1. 水凝膠組織粘合劑的設計策略。
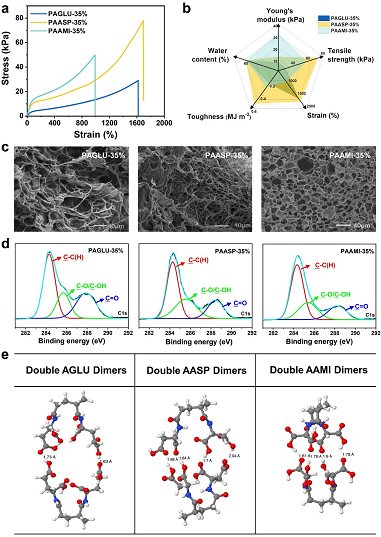
圖2. PAGLU, PAASP和PAAMI 水凝膠之間的比較。
從SEM,XPS以及模擬計算的結果分析,由于側鏈亞甲基對空間位阻的影響,PAAMI,PAASP和PAGLU三種水凝膠基體內部參與形成氫鍵的羧基數目依次減少。PAGLU水凝膠基體氫鍵交聯密度最低,力學性能相對較差;對于PAAMI水凝膠,水凝膠基體中大部分羧基參與形成氫鍵,界面相互作用相對較弱;PAASP水凝膠部分羧基參與氫鍵締合有效耗散能量,部分游離羧基與界面形成強相互作用,兩者協同作用滿足粘接劑的基本需求,表現出更為優異的力學性能和粘接性能。

圖3. PAASP水凝膠的粘附性能。
PAASP水凝膠對組織的粘接強度可以達到120 kPa,與共價交聯組織粘接劑相當,可以有效密封組織,閉合傷口。為避免水凝膠在組織修復過程中引起術后粘連造成二次損傷,該工作利用紙基Fe3+轉印方法制備了具有 Janus 結構的組織修復貼片,其中Fe3+轉印一側由于羧基和Fe3+配位作用可以降低其與生物組織的粘接(粘接強度 7.9 kPa),而另一側保持對受損組織的有效粘接(粘接強度105 kPa)。該 Janus 水凝膠貼片可以在老鼠體內胃穿孔模型中同時實現傷口愈合和術后防粘連,有望在創傷修復中代替手術縫合得到應用。
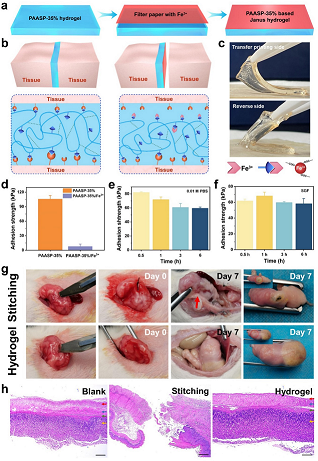
圖4. PAASP Janus水凝膠設計策略及作為組織貼片應用于胃穿孔修復。
相關工作以“Robust hydrogel adhesives for emergency rescue and gastric perforation repair”為題,發表于Bioactive Materials。論文的第一作者為西安交通大學化學學院研究生于靜,西安交通大學化學學院成一龍研究員為通訊作者。該研究工作得到國家自然科學基金、陜西省顱頜面精準醫學研究重點實驗室、西安交通大學“青年拔尖人才支持計劃”、陜西國際科技合作計劃等項目的支持。論文的表征及測試得到西安交通大學分析測試共享中心的大力支持。
原文鏈接:https://www.sciencedirect.com/science/article/pii/S2452199X22002201
- 太原理工大學張虎林教授 Adv. Sci.: 熱電凝膠賦能仿生多模自監督指尖受體 2025-07-02
- 浙大王征科課題組《Macromol. Rapid Commun.》: 泥鰍粘液-甲基丙烯酰化明膠超潤滑水凝膠 2025-06-30
- 西交大魏釗/北大楊根 Small 綜述: 力學性能可調動態水凝膠用于3D類器官培養 2025-06-27
- 南京工業大學遲波教授團隊 AFM:兼具即時粘附性和生物降解性的超分子組織粘合劑用于緊急止血和創傷修復 2024-03-04
- 中國科學院長春應化所欒世方/殷敬華團隊《Nat. Commun.》:基于原位自由基開環聚合策略構建主鏈可降解強力組織粘合劑 2023-10-04
- 中科院戴建武團隊 AFM:膠原基仿生組織粘合劑用于快速止血和加速傷口愈合 2022-12-31
- 浙工大馮杰/張靜團隊、浙江省人民醫院周佳 AHM:用于組織修復和預防術后粘連的“Janus”兩性離子水凝膠貼片 2024-12-10
