尋找理想的骨再生性植入物仍然是臨床上一個持續(xù)的挑戰(zhàn)。天然骨組織的微觀結構中,堅實的無機成分(羥基磷灰石)主要負責支撐、保護和承重,而柔軟的有機成分(膠原纖維,多糖)在干細胞的增殖和遷移中起著重要作用。因此,有效地模擬天然骨軟硬結合的雜化的結構與功能,有助于調控干細胞命運來改善骨再生進程。3D打印技術可以用于組織工程支架結構的精確控制,特別是創(chuàng)建有序孔隙和用戶自定義結構,被廣泛應用于組織工程領域。然而,目前以PCL,PLA等為主的擠出式3D打印支架難以提供組織重塑過程中長期穩(wěn)定的營養(yǎng)供給,同時其表面缺乏活性配體,這會導致無效的細胞粘附和下游細胞事件,難以模擬骨組織再生過程所需的生理微環(huán)境。
針對以上問題,四川大學生物醫(yī)學工程學院/國家生物醫(yī)學材料工程技術研究中心孫勇研究員/樊渝江教授在前期的工作基礎上(Nat. Commun., 2022; Adv. Funct. Mater., 2023),利用多巴胺介導的化學整合,將仿生胞外基質凝膠修飾在聚多巴胺涂層的3D打印PCL支架中,構建了軟-硬結合的活性骨修復體(BM-g-DPCL,圖1)。該策略改善了3D打印支架植入后的再生微環(huán)境,對于成骨基質的重塑起到重要作用。其中,梯度多孔結構設計有利于潛在的細胞遷移和營養(yǎng)傳質;聚多巴胺涂覆的“硬”性PCL支架促進鈣離子螯和及隨后的類骨質沉積,并維持植入體的力學環(huán)境;多酚基團化學錨定的“軟”性凝膠基質改善再生微環(huán)境,增強了干細胞的粘附、增殖和成骨分化。活性骨修復體(BM-g-DPCL)加速內源性干細胞(ESCs)募集,并啟動了快速的血管形成(圖2)。在兔顱骨缺損模型(Φ = 10 mm)中,活性支架促進新生組織與植入體界面融合,誘導新生骨基質在支架內部沉積(圖3)。蛋白質組學確認細胞因子粘附、生物礦化沉積、快速血管化及促進胞外基質形成是加速骨缺損愈合的主要因素(圖4)。這種仿生的軟硬組分高度化學鍵和的策略提供了無細胞/無因子的組織工程支架再生的新策略。
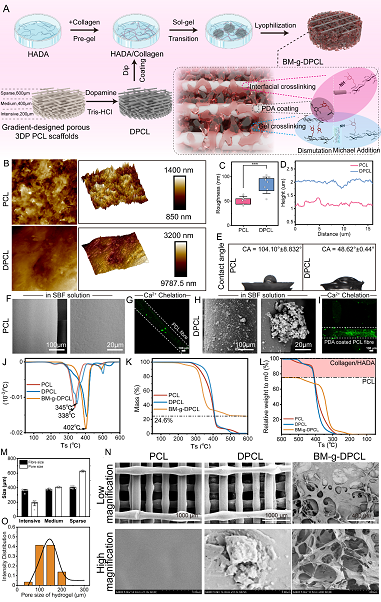

圖2 仿生基質加速rBMSCs體外遷移和體內內源性干細胞(ESCs)募集


圖4 差異的蛋白表達揭示成骨分化機制
原文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/smll.202206960
- 香港城市大學王彬課題組 CEJ:植物啟發(fā)梯度孔氣凝膠 - 實現(xiàn)界面蒸發(fā)中的快速水傳輸與低蒸發(fā)焓 2025-07-10
- 廈門大學曹學正教授 Macromolecules:高強高黏超流體動態(tài)高分子網(wǎng)絡的仿生設計及跨尺度流變理論模擬揭秘 2025-07-03
- 太原理工大學張虎林教授 Adv. Sci.: 熱電凝膠賦能仿生多模自監(jiān)督指尖受體 2025-07-02
- 浙江大學吳晶軍、方子正團隊 Adv. Mater.:3D打印超強韌可修復彈性體 2025-07-07
- 南理工/國科大杭高院王杰平、南理工易文斌等 Nat. Commun.:可消除光固化3D打印層紋的聚二硫代氨基甲酸酯研究 2025-07-03
- 昆士蘭大學喬瑞瑞團隊 Adv. Mater. 綜述:納米復合材料的創(chuàng)新制備與應用 - 從傳統(tǒng)合成到先進3D打印技術 2025-06-25
- 西安交大郭保林教授《Natl. Sci. Rev.》:細菌響應程序化自激活抗菌水凝膠用于重塑傷口再生微環(huán)境以促進感染傷口愈合 2024-02-16
