傷口組織中的微環(huán)境再生對(duì)傷口愈合至關(guān)重要。然而,實(shí)現(xiàn)理想的傷口微環(huán)境再生涉及多個(gè)階段,包括止血、炎癥、增殖和重塑。傳統(tǒng)的傷口敷料面臨著完全操縱所有這些階段以實(shí)現(xiàn)快速和完全傷口愈合的挑戰(zhàn)。

近日,浙江工業(yè)大學(xué)藥學(xué)院的楊根生教授、楊慶良副教授團(tuán)隊(duì)成功制備了一種基于明膠甲基丙烯酰基(GelMA)和羧甲基殼聚糖(CMCS)的負(fù)載VEGF多功能傷口水凝膠(GelMA-CMCS@VEGF)敷料。該水凝膠可通過紫外線照射輕松制造,新設(shè)計(jì)的水凝膠不僅由于CMCS活性基團(tuán)與生物組織的相互作用而表現(xiàn)出強(qiáng)大的組織粘附能力,而且對(duì)頻繁移動(dòng)的皮膚和關(guān)節(jié)具有理想的可擴(kuò)展性能。此外,水凝膠在血細(xì)胞凝固、止血和細(xì)胞募集方面表現(xiàn)出卓越的能力,從而促進(jìn)內(nèi)皮細(xì)胞的增殖、粘附、遷移和血管生成。并且體內(nèi)研究表明,水凝膠通過抑制炎癥、調(diào)節(jié)巨噬細(xì)胞的M1/M2極化、顯著促進(jìn)膠原沉積;持續(xù)釋放VEGF,刺激血管生成、上皮化和組織重塑,大幅縮短了止血時(shí)間,取得了令人滿意的治療效果。總之,該多功能水凝膠敷料具有組織工程和再生醫(yī)學(xué)應(yīng)用潛力,在加速傷口愈合各階段的促進(jìn)效果提供指導(dǎo)策略。


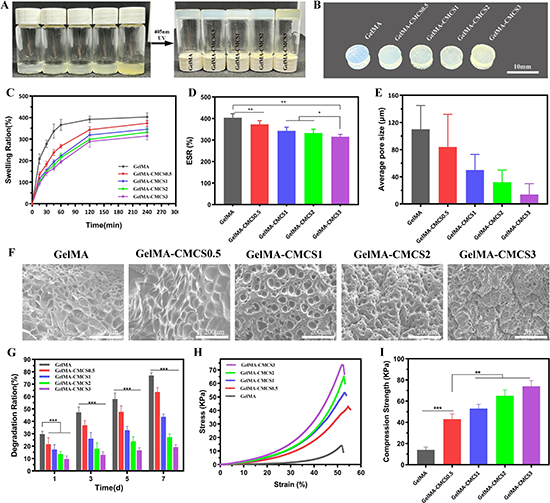
圖3. GelMA-CMCS水凝膠的結(jié)構(gòu),固化性能,溶脹和降解能力,力學(xué)表征

圖4. GelMA-CMCS水凝膠的粘合性能,流變性能,藥物釋放性能和生物降解性
為了得到負(fù)載VEGF的復(fù)合水凝膠,將不同濃度的VEGF加入到水凝膠前提溶液中。以紫外光交聯(lián)的形式形成GelMA-CMCS1@VEGF。以HUVECs(人臍靜脈內(nèi)皮細(xì)胞)作為實(shí)驗(yàn)對(duì)象,將其注射入凝膠,在五天內(nèi)評(píng)估細(xì)胞活力及增值情況,結(jié)果表明,CMCS1@VEGF水凝膠對(duì)血管內(nèi)皮細(xì)胞的粘附和增殖比GelMA組和GelMA-CMCS1組水凝膠高。在小管形成測(cè)定和MTT細(xì)胞實(shí)驗(yàn)后,均顯示GelMA-CMCS1@VEGF在生物安全性和促成血管方面具有顯著優(yōu)勢(shì)。

圖5.水凝膠的體外細(xì)胞相容性、細(xì)胞活力、粘附、遷移和血管化評(píng)估
血液相容性被認(rèn)為是決定止血生物材料安全性和有效性的重要因素,所有水凝膠組的溶血率均低于5%,表明它們具有良好的血液相容性,在水凝膠組中,GelMA-CMCS1@VEGF顯示出最低的溶血率為1.88%,表明血液相容性優(yōu)越。同時(shí)其優(yōu)異的血液吸收和聚集能力,也能夠促進(jìn)血液凝固。此外,我們對(duì)大鼠肝出血模型進(jìn)行了體內(nèi)止血實(shí)驗(yàn)。在未處理(空白組),紗布組,纖維蛋白膠組,GelMA,GelMA-CMCS1和GelMA-CMCS1@VEGF六組對(duì)比中,各組失血量值分別為263 mg,202 mg,47 mg,68 mg,49 mg和34 mg。相應(yīng)的凝固時(shí)間分別約為164 s、136 s、45 s、72 s、41 s和33 s。證明CMCS和VEGF的存在顯著改善了止血效果。

圖6.血液相容性,體外全血凝固試驗(yàn),以及水凝膠的體內(nèi)止血特性
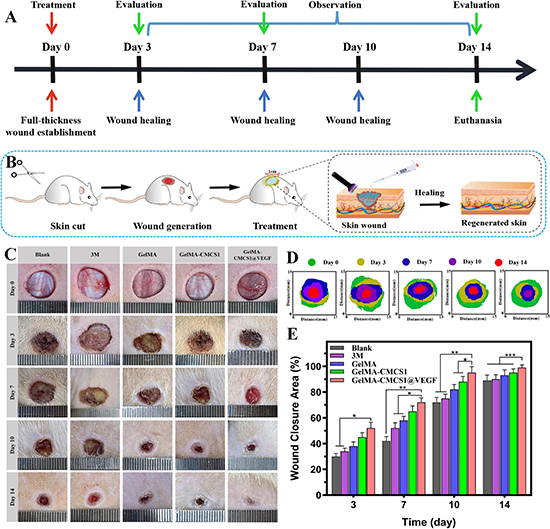

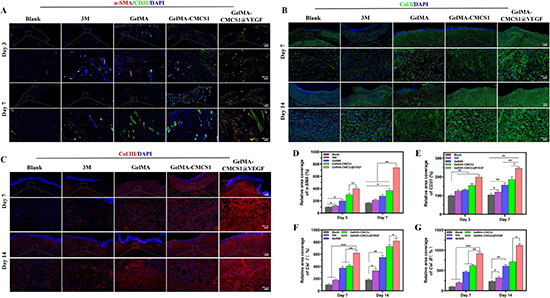

圖10.抗炎,免疫調(diào)節(jié)能力和上皮組織形成
綜上所述,該團(tuán)隊(duì)已經(jīng)成功開發(fā)出具有可調(diào)諧三維網(wǎng)絡(luò)結(jié)構(gòu)的VEGF(GelMA-CMCS@VEGF)的光固化水凝膠。基于所應(yīng)用的生物材料和可編程的多孔結(jié)構(gòu),所開發(fā)的GelMA-CMCS@VEGF水凝膠不僅具有較強(qiáng)的組織粘附性、可控的溶脹行為、生物降解性和理想的緩釋性,而且滿足了傷口環(huán)境的適應(yīng)性和細(xì)胞調(diào)節(jié)能力,包括改善細(xì)胞粘附、遷移、管形成和增殖。在抗炎性能反面,可以很好地調(diào)節(jié)傷口部位的微環(huán)境,有效地促進(jìn)皮膚和血管再生、上皮組織形成和膠原蛋白沉積。此外,所開發(fā)的水凝膠敷料表現(xiàn)出優(yōu)異的血液相容性和止血性能,并且能夠?qū)⒕奘杉?xì)胞的M1表型極化為M2表型,以減輕有害炎癥并有效促進(jìn)血管生成。總體而言,本研究的體外和體內(nèi)結(jié)果表明,GelMA-CMCS@VEGF水凝膠敷料在處理全層皮膚傷口方面具有廣闊的前景,具有巨大的臨床轉(zhuǎn)化潛力。
原文鏈接:https://doi.org/10.1016/j.ijbiomac.2023.127151
- 西華師范大學(xué)劉琦課題組 CEJ:無引發(fā)劑太陽能光聚合制備高性能、寬環(huán)境適應(yīng)性和可回收水凝膠傳感器 2025-06-26
- 南京大學(xué)成義祥教授團(tuán)隊(duì) Angew: 圓偏振紫外光激活的不對(duì)稱光聚合反應(yīng)用于合成具有圓偏振發(fā)光活性的材料 2025-03-09
- 北京師范大學(xué)鄒應(yīng)全教授團(tuán)隊(duì) CEJ:基于近紅外光聚合的立體光刻3D打印技術(shù) 2025-02-24
- 東華大學(xué)史向陽教授團(tuán)隊(duì):外泌體包裹的響應(yīng)性樹狀大分子納米凝膠可實(shí)現(xiàn)急性肺損傷的免疫調(diào)節(jié)和抗氧化聯(lián)合治療 2025-05-15
- 東南大學(xué)葛麗芹教授團(tuán)隊(duì) CEJ 綜述:具有免疫調(diào)節(jié)特性的工程化微膠囊在癌癥、炎癥和自身免疫中的應(yīng)用 2025-04-09
- 四川大學(xué)楊佼佼副研究員、王端副教授、周宗科教授 CEJ:超聲激發(fā)的工程化益生菌胞外囊泡涂層用于抗植入體感染和免疫調(diào)節(jié) 2024-12-30
- 山大周傳健教授、濟(jì)大趙松方/關(guān)瑞芳教授 AFM: 聚合誘導(dǎo)微相分離和多尺度靜電相互作用協(xié)同構(gòu)建高強(qiáng)韌、高有機(jī)硅含量的有機(jī)硅水凝膠 2025-07-03
