由創傷、感染和腫瘤切除的發生率不斷增加,大型骨缺損的治療在世界范圍內是一個主要的臨床問題。為了實現大面積骨缺損的成功愈合,需要在缺損部位植入合適的骨移植物。目前自體骨移植和同種異體移植是治療臨界骨缺損的重要手段,也是金標準。然而,這類骨移植物的局限性,如供體稀缺、病原體轉移和免疫排斥等,極大地阻礙了其臨床應用。骨組織工程已經成為一種有效的骨修復方法,許多骨組織工程支架被開發,但常用的支架材料(如陶瓷、金屬、高分子材料等)生物惰性且支架結構簡單,不能實現良好的骨再生能力。因此,近年來基于仿生骨修復的策略備受關注,如從生物學活性或物理結構方面進行仿生。然而,骨組織在重建時需要大量干細胞遷移到缺損處定植和分化并有豐富血管提供養分,同時需要足夠的孔隙率,為細胞的黏附和血管化以及新骨生成提供空間、為營養獲取和新陳代謝提供交換通道。僅實現物理結構或生物活性某一方面的仿生都難以獲得最佳的骨修復性能。
針對以上挑戰,華東理工劉潤輝教授與合作者合作研發了一種兼具物理結構與生物活性功能的雙仿生 3D 打印的大段骨修復支架。這種模擬結構的支架具有各向同性的單細胞結構,適用于承受不同負荷要求的缺損情況,并且允許血管和骨向內生長。同時,為了實現仿生生物功能,采用劉潤輝課題組前期發現的模擬細胞外基質肽的β-氨基酸聚合物 DM50CO50 來促進細胞黏附(Nat. Commun. 2021, 12, 562.)。這種沒有特定氨基酸序列和結構的聚合物,能夠促進干細胞黏附,其效果可與金標準RGD相媲美,并且克服了與肽相關的蛋白水解問題。并通過課題組前期發現的DbaYKY 的三肽來引發聚合反應,從而能夠快速且高效地將聚合物功能化到支架表面(Nat. Commun. 2021, 12, 6331)。此外,通過將去鐵胺(DFO)與亞氨基二乙酸(IDA)偶聯對其進行修飾,賦予其尋鈣能力。所得的合成分子(SF-DFO)可螯合到硅鈣石支架及其他含鈣支架上,作為一種涂層材料將 DFO 的血管生成特性嫁接到支架上。管形成實驗表明,SF-DFO 與 DFO 一樣能促進血管生成,因為二者均能夠促使類血管管腔形成。這種雙仿生的3D 打印支架能夠有效促進大段骨修復,為仿生骨修復材料設計提供新的思路。
2024年12月26日,該研究成果以“3D-Printed Dual-Bionic Scaffolds to Promote Osteoconductivity and Angiogenesis for Large Segment Bone Restoration”為題發表在Advanced Functional Materials上(Adv. Funct. Mater. 2024, 2422691 DOI: 10.1002/adfm.202422691)。

圖1. 雙仿生 3D 打印的白硅鈣石支架
首先,為實現對物理結構的仿生,作者選擇了一種成分與骨基質相似的白硅鈣石生物陶瓷作為基材,通過3D打印技術制備具有各向同性單細胞結構且孔隙率約為 59%±5% 的支架。這種孔隙率便于血管和骨向內生長,為骨再生提供了必要的支撐(圖 1a)。該支架的抗壓能力與傳統的交叉結構支架相當,而在抗彎、抗剪以及抗扭方面則更勝一籌,這使得這一支架能夠通過為新骨形成提供適當的應力刺激,同時有效防止過度的應力遮擋,適用于承受不同負荷要求的缺損情況。
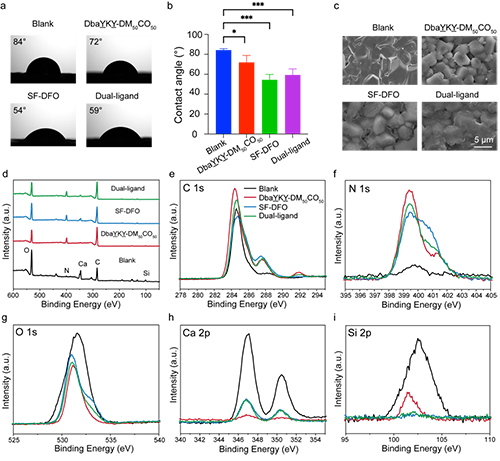
圖2. 支架材料的表面表征
將促細胞黏附多肽和DFO雙重修飾的支架材料接種綠色熒光蛋白(GFP)- 熒光素酶(Luc)標記的骨髓間充質干細胞(BMSCs)的支架皮下植入裸鼠體內。在植入后的第 0、3 和 5 天進行生物發光成像。結果顯示,該支架不僅能夠在體外促進細胞增殖,而且還能提高體內的細胞存活率。另外,與在普通培養基中培養細胞且無額外干預的陰性對照組相比,DFO 和 SF-DFO 均顯著上調了 HO-1 和 VEGF 的表達。
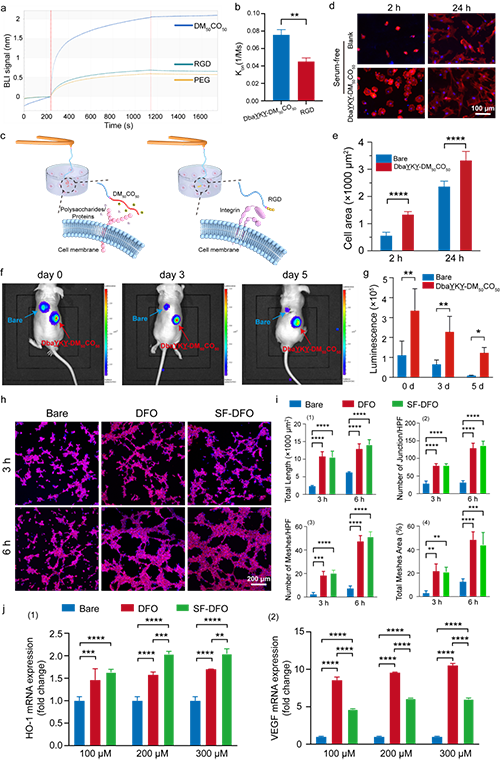
圖3. 支架材料促細胞黏附和促血管生成效果
這種 3D 打印的硅鈣石支架的壓縮模量和剛度分別高達 6 GPa和 5000 N/mm,這大大超過了骨小梁支架 2 GPa的最低要求。作者設計的支架平均孔徑為 450 μm,孔隙率為 59%,在機械完整性和生物學性能之間實現了最佳平衡,超過了骨組織工程支架 50 至 900 μm的平均范圍。這種設計確保了有充足的空間來供應氧氣和營養物質,這對于促進支架孔隙內的血管生成和成骨作用至關重要。
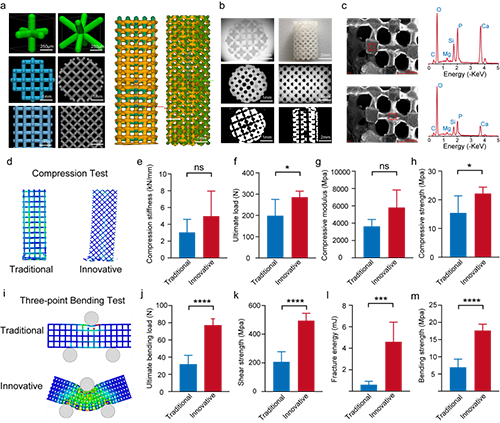
圖4. 支架材料的力學性能

圖5. 支架材料的成骨分化
作者設計的這種具有雙重仿生設計理念的骨修復支架不僅在體外展示了良好的干細胞粘附和血管形成效果,大鼠的大斷骨缺損模型也驗證了該支架優異的成骨和成血管能力,顯著加速了臨界尺寸骨缺損的修復。這一結果證實了結構和功能的雙重模擬,將更加有效的模擬天然骨組織并利于相互功能的發揮,也進一步為臨床前應用奠定了堅實的基礎。
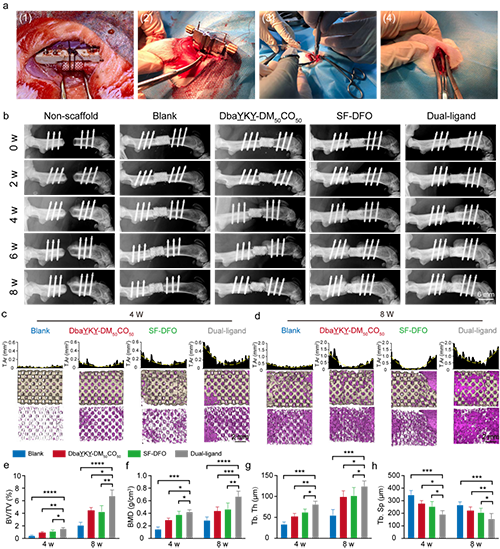
圖6. 大斷骨缺損體內修復

圖7.體內血管形成效果
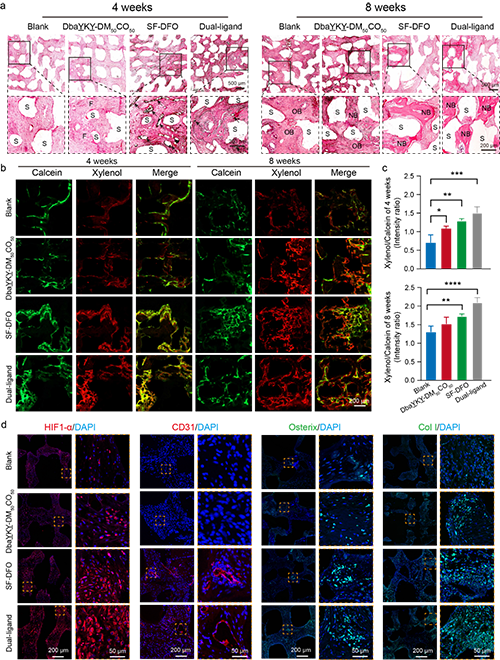
圖8. 體內骨修復效果
上海交通大學陳博博士、華東理工大學特聘副研究員陳琦為該論文的第一作者,華東理工大學劉潤輝教授為通訊作者。該研究得到了國家自然科學基金委、科技部等基金的資助。
論文鏈接:https://doi.org/10.1002/adfm.202422691








