植入3D 打印支架是治療骨缺損的有效方法之一。然而,骨骼修復的過程極其復雜,涉及炎癥階段、修復階段和重塑階段,每個階段都需要一系列生物活性分子的協調控制。因此,理想的骨修復支架應能夠根據骨組織愈合過程釋放不同生物活性分子。近日,暨南大學羅丙紅教授團隊聯合中國科學院深圳先進技術研究院的賴毓霄研究員團隊共同開發了一種具有多種藥物和活性分子分時控釋的多功能3D打印促骨再生支架。

該團隊通過聚多巴胺(PDA)成功地將天然抗菌劑—丁香酚和載有成血管的二甲基草酰甘氨酸(DMOG)的層狀雙氫氧化物(LDHs)加載到 3D 打印的 PLLA 支架表面(圖1)。由于丁香酚的早期釋放,支架最初表現出很強的抗菌作用,而 LDH 持續釋放的 DMOG 在后期提供了促進長期的成骨和血管生成的能力。此外,負載DMOG的LDH進行表面改性有效地增強了 3D 打印 PLLA 支架的機械性能。重要的是,LDH的存在還通過釋放 Mg2+賦予了支架優異的成骨活性,可與 DMOG 和丁香酚協同作用,刺激血管生成和成骨分化。分時控釋的活性支架有望成為骨組織工程支架非常有效的構建方法。

圖1. 利用 DMOG 和丁香酚的時空控釋并協同離子效應構建多功能 3D 打印 PLLA 復合支架示意圖
在這一研究中,該團隊利用PDA將負載DMOG的LDHs(LDHsD)和丁香酚(Eug)同步修飾到3D打印的PLLA支架表面。由于PDA與LDH含有豐富的氨基和羥基,因此修飾后的復合支架親水性增強。此外,LDH也在一定程度上提高了PLLA支架的力學性能,數據表明在濕態下,復合支架的壓縮模量和強度分別比純PLLA支架高11.4%和 7.9%(圖2)。親水性的改善與力學性能的增強均有利于促進細胞的粘附和鋪展,從而提高支架材料的細胞親和性。

圖2. 支架的理化性能表征
體外藥物釋放實驗顯示了丁香酚的早期快速釋放,以及DMOG和Mg2+的長期持續釋放的結果,這也印證了體外抗菌實驗中添加有丁香酚的復合支架對金黃色葡萄球菌和大腸桿菌的24小時抑菌率均達到85%以上。與此同時,體外細胞實驗也顯示了復合支架優異的生物相容性和細胞親和性(圖3)。

圖3. 支架的體外抗菌活性、細胞毒性與細胞粘附性能
通過體外成骨與成血管化實驗的深入驗證,該研究證實了LDHs、DMOG與丁香酚協同促進了成骨基因與成血管基因的上調,從而表現出支架的鈣結節生成能力的提高以及細胞遷移能力與小管形成性能的改善(圖4)。此外,通過體內大鼠顱骨臨界性缺損動物模型發現復合支架組的骨體積分數(BV/TV)和體積骨密度 (BMD) 均顯著高于 BLANK 組和 PLLA 組,由此也進一步驗證了復合支架優異的促進骨生成的能力(圖5)。
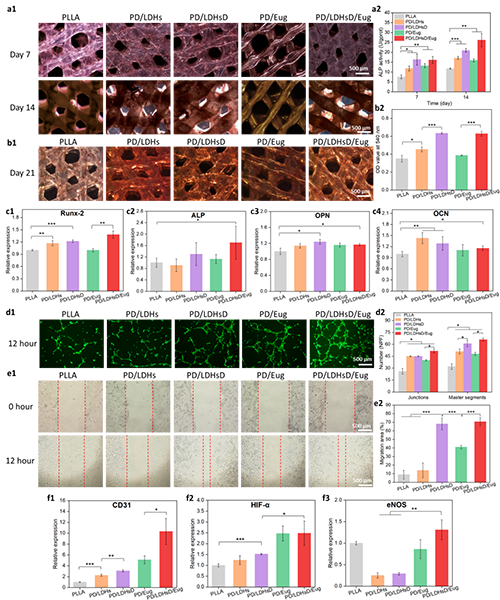
圖4. 支架的體外成骨成血管化實驗表征

圖5. Micro-CT分析評估植入支架修復大鼠臨界性顱骨缺損效果
相關工作以“Versatile 3D Printing Scaffold with Spatiotemporal Release of Multiple Drugs for Bone Regeneration”為題發表在《ACS Nano》(doi:10.1021/acsnano.4c13265)上,暨南大學化學與材料學院羅丙紅教授與中國科學院深圳先進技術研究院的賴毓霄研究員為論文共同通訊作者,暨南大學化學與材料學院2020級研究生朱澤林與中國科學院深圳先進技術研究院的副研究員李彩榮為論文的共同第一作者。該研究得到國家自然科學基金、廣東省自然科學基金和重點研發計劃等多方支持。
原文鏈接:https://doi.org/10.1021/acsnano.4c13265
