三陰性乳腺癌(TNBC)是乳腺癌中最具侵襲性和致死性的亞型,由于缺乏雌激素受體、孕激素受體和人表皮生長因子受體2的表達,導致傳統激素療法及靶向治療失效,臨床主要依賴化療但存在療效低、毒副作用顯著等局限。聯合治療已成為近年來TNBC的新型療法,如免疫治療與化療、放療以及靶向治療的組合,但存在免疫相關不良反應的風險。近年來,基于生物礦化的新型阻斷療法因其優良生物相容性和持續誘導礦化能力在腫瘤治療領域備受關注。
生物礦化是生物體對無機物質成核、生長和定向組裝進行精準調控,進而形成硬組織材料的過程。腫瘤靶向礦化阻斷策略,創新性地將病理性礦化引入腫瘤治療中。該策略主要依賴于羧基、雙膦酸鹽等基團作為礦化位點誘導腫瘤組織周圍形成礦物質屏障,這層物理屏障能夠有效阻斷腫瘤細胞與周圍微環境之間的營養代謝交換及信號分子傳遞,在乳腺癌、宮頸癌和骨肉瘤等惡性腫瘤治療中展現出顯著療效。此外,纖連蛋白(Fibronectin, FN)含有的精氨酸-甘氨酸-天冬氨酸(RGD)序列能夠特異性識別腫瘤細胞表面高表達的αvβ3整合素受體,兼具靶向識別性能和生物相容性。
腫瘤組織的礦化過程會導致局部血液供應減少,加重腫瘤的缺氧狀態。這一特性可被用于激活生物還原性藥物如替拉扎明(Tirapazamine, TPZ),促使其轉化為具有細胞毒性的活性形式。通過合理設計和優化基于生物礦化的阻斷治療和乏氧激活化療可以為TNBC聯合治療提供新的可能。
含磷樹狀大分子因其良好的生物相容性和可修飾性,表現出極佳的蛋白、藥物的遞送效率,被廣泛用于腫瘤和炎癥等疾病的治療。尤其是,以雙膦酸鹽封端的含磷樹狀大分子不僅通過簡單物理作用高效負載蛋白質,其末端基團還可作為礦化誘導位點。因此,設計基于雙膦酸鹽封端的含磷樹狀大分子納米平臺有望整合腫瘤特異性識別、礦化誘導和藥物控釋等功能為一體用于協同治療TNBC。
為此,東華大學沈明武研究員/史向陽教授團隊與法國國家科學研究中心Jean-Pierre Majoral院士團隊合作構建了一種負載TPZ的含磷樹狀大分子/FN納米復合物(圖1)。研究團隊以雙膦酸鹽封端的含磷樹狀大分子AK176為載體,通過氫鍵、陽離子-π及疏水相互作用將AK176與FN復合,進一步通過靜電相互作用負載TPZ,得到AK176@FN/TPZ納米復合物(AFT NCs)。所制備的AFT NCs具有良好的穩定性,能夠通過FN介導的靶向作用識別腫瘤細胞,并以AK176末端的雙膦酸鹽基團作為鈣沉積位點誘導生物礦化,加劇腫瘤乏氧微環境激活TPZ,實現TNBC的協同阻斷治療/乏氧激活化療。
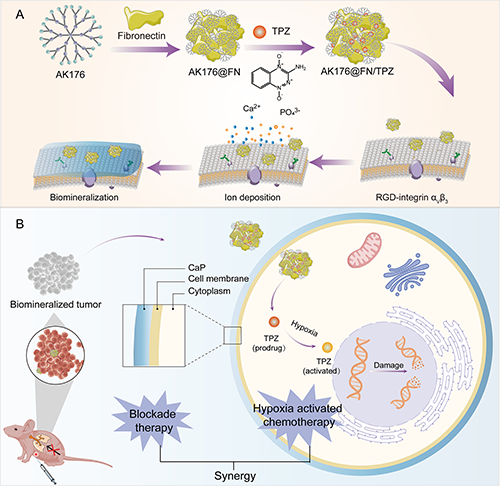
圖1. AFT NCs的制備及其介導三陰性乳腺癌協同治療機制。
TEM圖像顯示所制備的AF NCs和AFT NCs的形貌為均勻分散的球形結構,尺寸大小分別為102.9 nm和134.1 nm(圖2A-B)。AFM圖像顯示AF NCs和AFT NCs的高度分別為15.6 nm和26.1 nm,初步證明TPZ在AF NCs中的成功負載(圖2C-D)。此外,UV-vis圖譜、SDS-PAGE圖像以及表面電勢進一步證明了FN和TPZ的成功負載(圖2E-H)。AFT NCs的水合動力學尺寸為244.2 nm,PDI為0.21,表面電勢為-10.8 mV(圖2G-H)。
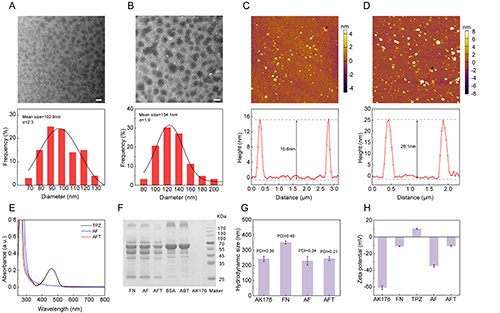
圖2.(A)AF NCs和(B)AFT NCs的TEM圖像及尺寸分布直方圖;(C)AF NCs和(D)AFT NCs的AFM圖像及高度分布圖;不同材料的(E)UV-Vis圖譜、(F)SDS-PAGE圖譜、(G)水合粒徑和(H)表面電勢。
研究團隊發現AFT NCs在30分鐘孵育時間內能最大程度地定位在MDA-MB-231細胞膜表面(圖3A),并通過FN介導的靶向作用特異性結合αvβ3整合素(圖3B)。CLSM和共定位分析進一步證明,AFT NCs與細胞孵育30 min使納米材料傾向于附著在細胞膜表面而非內化(圖3C-D)。AFT NCs的雙膦酸鹽基團可有效誘導癌細胞膜表面的生物礦化,在無外源鈣補充條件下,AFT NCs能利用培養基中的鈣形成磷酸鈣礦化層,表現為明顯的鈣黃綠素相關的綠色熒光信號(圖3E),而額外補充鈣的AFTC組礦化效果更明顯(圖3F)。EDX分析顯示,礦化層由無序的鈣磷沉積物組成,Ca/P比接近羥基磷灰石理論值(圖3G-H)。此外,AFTC處理可特異性降低MDA-MB-231細胞培養液的鈣濃度(圖3I-J),表明AFT NCs能夠定位到腫瘤細胞表面并吸附外源性鈣離子,實現腫瘤靶向生物礦化。

圖3.(A)MDA-MB-231細胞與AFT-FITC共孵育不同時間,臺盼藍淬滅前后的熒光強度流式細胞圖;MDA-MB-231細胞與AFT-FITC共孵育30分鐘后的(B)流式細胞圖和(C)CLSM圖像;(D)細胞膜與AFT-FITC的共定位分析:煙花圖像及皮爾遜相關系數;(E)經不同處理后MDA-MB-231細胞表面CaP層的CLSM圖像;(F)經不同處理后MDA-MB-231細胞的SEM圖像及鈣元素分布圖;(G-H)PBS和AFTC處理后MDA-MB-231細胞的EDX能譜圖;經不同處理后(I)L929細胞和(J)MDA-MB-231細胞上清液中Ca2+濃度。
接下來,研究團隊通過一系列體外實驗探究AFT NCs介導的生物礦化策略的抗腫瘤機制(圖4A)。由于FN介導的靶向作用,AFTC誘導的細胞表面礦化能顯著抑制MDA-MB-231細胞的增殖,而對正常L929細胞無明顯影響(圖4B)。進一步研究發現,生物礦化處理后的MDA-MB-231細胞凋亡率顯著增強(圖4C),同時其遷移和侵襲能力也受到抑制,且該抑制效果隨著鈣離子補充而增強(圖4D-I)。這些結果表明,外源鈣離子的補充促進AFT NCs的生物礦化的效果,抑制細胞內氧氣和能量的運輸,從而激活乏氧前藥TPZ的化療活性,導致有效的癌細胞凋亡和抗遷移/侵襲能力,為AFT NCs在體內抑制腫瘤增殖和轉移提供了依據。
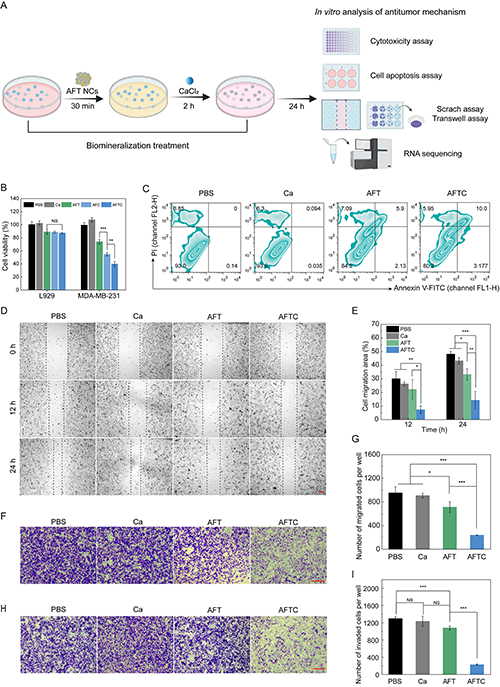
圖4.(A)生物礦化處理MDA-MB-231細胞的示意圖;(B)經不同處理后L929和MDA-MB-231細胞的細胞活力圖;經不同處理后MDA-MB-231細胞的(C)凋亡流式分析圖、(D-E)劃痕實驗、(F-G)Transwell遷移實驗及(H-I)Transwell侵襲實驗的代表性圖像和定量數據。
隨后,研究團隊通過RNA測序揭示了AFTC誘導的細胞表面礦化作用機制。轉錄組分析顯示,AFTC處理組與PBS組存在487個差異表達基因(176個上調,311個下調)(圖5A)。KEGG富集分析表明,礦化作用主要通過影響IL-17、PI3K-Akt、HIF-1α等信號通路,以及細胞黏附因子和代謝合成來誘導細胞死亡(圖5B-C)。GO分析顯示差異基因顯著富集于“生物調控”、“代謝過程”、“缺氧響應”等生物學過程(圖5D-E)。熱圖顯示,AFTC組中EDN2、NOX5等促遷移基因表達下調,而TNFSF14等促凋亡基因表達上調(圖5G)。這些結果說明AFTC誘導的膜礦化通過破壞代謝穩態、誘導凋亡和抑制遷移等多途徑發揮抗腫瘤作用。

圖5.(A)PBS和AFTC處理后MDA-MB-231細胞的差異表達基因火山圖;差異表達基因(B)KEGG注釋分類及(C)富集分析;差異表達基因(D)GO注釋分類及(E)生物學過程、(F)分子功能層面的富集分析;(G)|log2(FC)|≥1.5的代表性差異表達基因熱圖。
研究團隊通過構建MDA-MB-231三陰性乳腺癌原位移植瘤模型驗證AFT NCs的體內治療效果(圖6A)。在圖6B-C中,AFTC可通過增強的生物礦化作用協同加劇腫瘤缺氧來激活TPZ,從而顯著抑制腫瘤生長。ICP-OES檢測顯示AFT和AFTC組腫瘤組織鈣含量顯著升高(圖6D)。Micro-CT成像進一步證實AFT NCs介導的生物礦化能在腫瘤組織周圍作用形成致密的礦物層(圖6E-F)。總的來說,通過生物礦化介導的阻斷治療與缺氧激活化療的協同作用,實現了顯著的體內抗腫瘤效果。

圖6.(A)原位三陰性乳腺癌異種移植模型的治療時間線;(B)治療期間各組小鼠腫瘤體積變化;治療后各組小鼠(C)腫瘤代表性照片、(D)腫瘤組織的鈣含量、(E)腫瘤組織Micro-CT成像圖及(F)礦化體積定量結果。
研究團隊通過組織學分析揭示了AFT NCs的體內抗腫瘤機制。治療后小鼠腫瘤組織壞死區域增加、增殖指標(Ki-67)減少、凋亡指標(caspase-3)增加和乏氧指標(HIF-1α)表達增加,表明礦化作用加劇了腫瘤微環境的缺氧,從而激活TPZ的化療活性(圖7A-B)。此外,存活率和肺轉移實驗進一步表明,AFT NCs介導的生物礦化策略能夠增加小鼠的存活率及有效抑制體內腫瘤肺轉移(圖7C-D)。
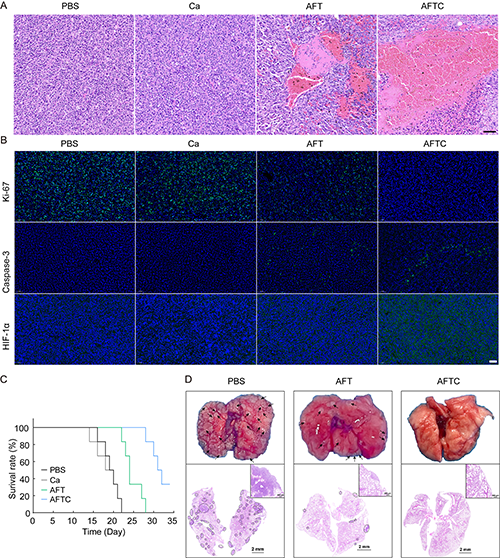
圖7.治療后各組小鼠腫瘤組織的(A)H&E染色及(B)Ki-67、Caspase-3和HIF-1α免疫熒光染色結果;(C)治療后各組小鼠的生存率;(D)治療后各組小鼠肺組織的代表性照片及H&E染色結果。
簡而言之,該研究設計的負載TPZ的含磷樹狀大分子/FN納米復合物(AFT NCs)具有多個優勢:1)AK176末端的雙膦酸鹽基團可作為鈣沉積的誘導位點;2)含磷樹狀大分子共負載FN和TPZ,不僅能實現腫瘤靶向生物礦化,還能通過加劇腫瘤乏氧微環境激活TPZ的化療活性;3)所構建的AFT NCs具有腫瘤特異性阻斷治療與化療協同效應,可有效抑制TNBC進展與轉移。這項研究為TNBC治療提供了一種新型的生物礦化策略,有望應用于治療其他惡性腫瘤。
以上研究成果以“Phosphorous Dendrimer-Mediated Biomineralization for Synergistic Blockade Therapy and Hypoxia-Activated Chemotherapy of Tumors”為題,在線發表于國際著名期刊Acta Biomaterialia (DOI: 10.1016/j.actbio.2025.04.038)。東華大學生物與醫學工程學院沈明武研究員、史向陽教授與鄒瑜(博士后)為共同通訊作者,東華大學碩士研究生梁佳佳為第一作者。該工作得到了國家重點研發計劃項目、國家自然科學基金項目、上海市科委項目等的資助。
文章鏈接:https://doi.org/10.1016/j.actbio.2025.04.038
- 東華大學沈明武研究員/史向陽教授團隊:不對稱含磷樹狀大分子遞送菠蘿蛋白酶用于骨關節炎的抗炎和軟骨保護治療 2025-06-13
- 東華大學史向陽教授團隊 Nano Today:基于含磷樹狀大分子的藥物遞送系統協同增強自噬、抗炎和抗氧化治療阿爾茨海默癥 2025-02-11
- 東華大學沈明武/史向陽Biomaterials:具有生物活性的含磷樹狀大分子共遞送蛋白質/藥物用于巨噬細胞重編程增強骨關節炎治療 2024-12-09
- 華東師大張利東教授、周立旻教授團隊 Carbohyd. Polym.:微生物礦化技術-打造生物可降解的超疏油海藻酸鹽水凝膠中空管 2025-03-10
- 四川大學楊剛教授團隊 ACS AMI:受生物礦化啟發的限域生長策略制備高性能聚酰亞胺氣凝膠 2024-01-11
- 四川大學吳宏教授、郭少云教授團隊 Small:受生物礦化啟發通過原位錨定硫化銅實現芳綸紡織品的多功能可穿戴熱管理 2023-11-14
