在生命科學與醫學領域,液-液相分離驅動的無膜細胞器是揭示細胞區室化機制的核心方向。應激顆粒等無膜細胞器通過相分離調控細胞應激響應,其快速組裝可保護mRNA和關鍵蛋白。同時,持續存在的應激顆粒與癌癥化療耐藥性相關,索拉非尼等藥物療效因受激顆粒影響顯著降低。因此,靶向調控此類無膜細胞器成為克服耐藥性的潛在策略。盡管已有針對其成分蛋白或上游通路的小分子藥物,但缺乏直接融合無膜細胞器并調節其活性的方法。
針對該挑戰,南開大學余志林教授課題組通過發展酶響應相分離多肽YSO4F,制備了具有無膜細胞器靶向的原位相分離凝聚物,實現了無膜細胞器靶向的腫瘤有效治療。該多肽分子以“粘合子-間隔子-粘合子”為原型,連接病毒來源FGDF結構域以靶向應激顆粒核心蛋白G3BP2。在溶酶體硫酸酯酶催化下,YSO4F轉化為相分離多肽YF并形成凝聚液滴,通過與G3BP2結合實現與應激顆粒融合,阻斷其對RACK1蛋白的隔離,激活促凋亡通路,顯著增強了索拉非尼的抗腫瘤效果,且生物安全性良好。該研究為靶向細胞器的癌癥治療提供了新策略。(圖1)

圖1.活細胞內多肽原位相分離形成液滴并靶向應激顆粒,與索拉非尼聯合進行癌癥化療示意圖。圖片來源Adv. Mater.。
作者首先介紹了具有原位液-液相分離能力的多肽分子YSO4F的酶響應水解以及酶響應相分離能力。研究團隊設計了含雙硫酸化酪氨酸的多肽YSO4F,其結構遵循“粘合子-間隔子-粘合子”基序,硫酸化修飾賦予其親水性及酶響應性。體外實驗表明,YSO4F在硫酸酯酶催化下逐步脫去硫酸基團,轉化為疏水性多肽YF,進而發生液-液相分離形成球形液滴。熒光漂白恢復及液滴融合實驗證實,該液滴具有典型的凝聚體動態特性,半恢復時間為23.4s,表明分子在液滴與胞質間快速交換(圖2)。
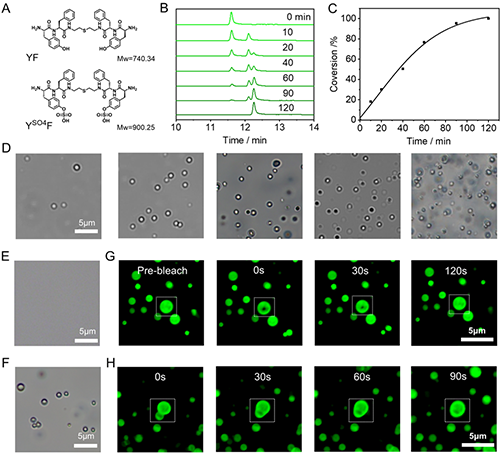
圖2.多肽YSO4F溶液中酶響應水解與酶響應相分離行為研究。圖片來源Adv. Mater.。
接下來研究團隊對細胞內的原位相分離過程進行了進一步研究(圖3),研究發現YSO4F通過網格蛋白介導的內吞作用進入細胞,定位于溶酶體后經硫酸酯酶催化去硫酸化,并通過質子海綿效應逃逸至細胞質,最終發生液-液相分離形成液滴。共聚焦激光掃描顯微鏡顯示,胞質內形成的液滴具備典型的液-液相分離特征,其熒光漂白后恢復特性證實了液滴與周圍環境中分子的快速交換能力。對照實驗顯示,當使用硫酸酯酶抑制劑預處理癌細胞,或在不過表達該酶的正常成纖維細胞中,均未觀察到液滴形成,充分驗證了酶響應是觸發原位相分離的關鍵條件。
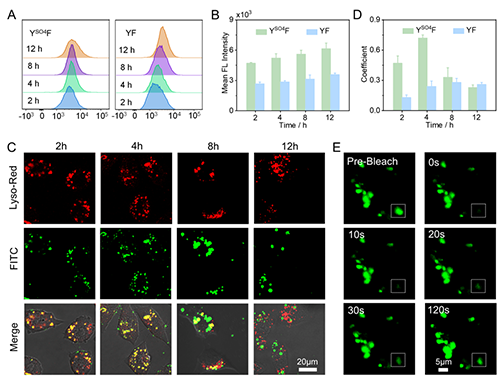
圖3.多肽YSO4F癌細胞內原位相分離行為研究。圖片來源Adv. Mater.。
在無膜細胞器靶向研究中,研究團隊通過引入能特異性結合應激顆粒核心蛋白G3BP2的配體FGDF,成功構建了m-YSO4F-LSG體系。該體系在腫瘤細胞內形成的功能性液滴(d-YF-LSG)可通過配體-蛋白識別作用,與應激顆粒發生特異性融合,實現對這一無膜細胞器的精準靶向。微量熱泳動實驗表明,液滴微環境使FGDF-YF與G3BP2的結合親和力提升3.9倍,顯著增強了對應激顆粒的募集效果。共聚焦激光掃描顯微鏡顯示,含有應激顆粒靶向配體的m-YSO4F-LSG體系具有優異的應激顆粒靶向能力。當與化療藥物索拉非尼聯合使用時,顯著提升了化療藥物對肺癌細胞的殺傷效力,使藥物半數抑制濃度大幅降低,細胞凋亡率顯著升高,為克服腫瘤化療耐藥性提供了關鍵的作用靶點和增效策略(圖4)。
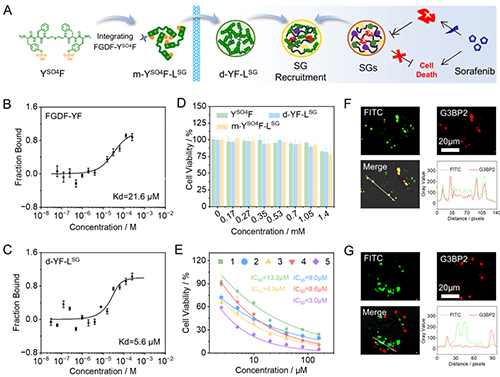
圖4.m-YSO4F-LSG對應激顆粒靶向性與化療增效研究。圖片來源Adv. Mater.。
研究團隊進一步對化療增效的機制進行研究,利用共聚焦激光掃描顯微鏡觀察到,經m-YSO4F-LSG處理并聯合索拉非尼刺激的腫瘤細胞中,液滴熒光信號與另一種應激顆粒核心組分TIA-1蛋白免疫熒光信號呈現高度共定位,線掃描分析顯示兩者重疊度顯著高于對照組。由于液滴未攜帶TIA-1靶向配體,這一現象直接證明液滴通過物理融合與應激顆粒結合,而非單個蛋白募集。同時,共聚焦實驗結果表明液滴與應激顆粒的融合能夠抑制其對RACK1蛋白的隔離。先前的研究表明,應激顆粒主要通過隔離蛋白RACK1并抑制MTK1-SAPK信號通路,從而阻止p38磷酸化和caspase-3活化,促進細胞存活。蛋白印跡實驗表明,液滴與應激顆粒的特異性融合觸發了MTK1蛋白的磷酸化激活,進而激活p38-MAPK信號通路級聯反應,最終導致促凋亡關鍵因子caspase-3的剪切活化(圖5)。
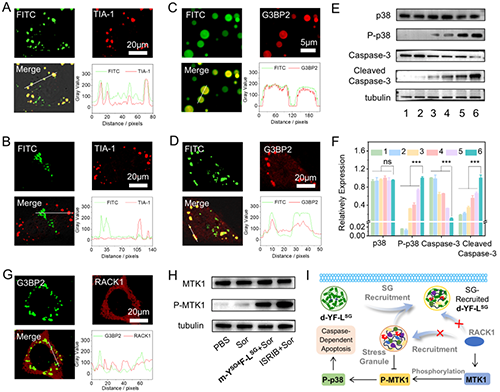
圖5.m-YSO4F-LSG的化療增效機制研究。圖片來源Adv. Mater.。
最后,在荷瘤小鼠的體內療效驗證中,研究團隊采用瘤內注射m-YSO4F-LSG 聯合腹腔注射索拉非尼的治療方案,結果顯示該聯合療法在21天的觀察期內實現了顯著腫瘤體積抑制,優于單一藥物治療組,展現出強大的協同抗腫瘤效應。免疫熒光分析進一步揭示,腫瘤組織中形成的功能性液滴與應激顆粒核心蛋白 G3BP2的共定位系數高達0.77,直接證實了液滴對應激顆粒的高效靶向能力。蛋白印跡檢測顯示,聯合治療組中p38磷酸化水平顯著升高,同時cleaved caspase-3蛋白表達量大幅增加,明確印證了caspase-3依賴凋亡通路的激活。重要器官的蘇木精和伊紅(H&E)染色及血液生化分析結果表明,m-YSO4F-LSG體系具有良好的生物相容性。

圖6.m-YSO4F-LSG的體內抗腫瘤化療增效與生物安全性研究。圖片來源Adv. Mater.。
這一成果近期發表在Advanced Materials上。南開大學碩士研究生王維庶和博士研究生王昊為共同第一作者,南開大學化學學院余志林教授為通訊作者。相關研究得到了科技部重點研發項目、國家自然科學基金委、天津市科技局和海河實驗室經費資助。
論文信息:
In Situ Liquid-Liquid Phase Separation of Peptides into Droplets Targeting Membraneless Organelles for Enhanced Cancer Chemotherapy
Weishu Wang, Hao Wang, Zhilin Yu*.
Advanced Materials.
論文鏈接:https://doi.org/10.1002/adma.202420399
- 港中深張祺/長春應化所段曉征 AFM:原位相分離構筑超強離子凝膠膠粘劑 2024-12-21
- 四川大學金勇教授課題組 CEJ:原位相分離構筑堅韌的多功能疏水離子凝膠 2023-11-04
- 西安交大胡建/北卡州立Michael Dickey《Nat. Mater.》:基于原位相分離制備高強韌可拉伸離子液體凝膠 2022-02-23
- 東華大學史向陽教授 Nano Today:仿生金屬-多酚網絡包覆彈性蛋白樣多肽膠束實現原位腦膠質瘤的聲動力/化學動力/免疫治療 2025-05-28
- 華東理工劉潤輝教授課題組 AFM:功能化聚-β-多肽組裝體抗耐藥真菌感染 2025-05-09
- 西北大學范代娣教授、朱晨輝教授、李陽副教授 AM:基于仿生凝血級聯途徑的多肽修飾脂質體納米顆粒可噴涂水凝膠治療不可壓破性創面出血 2025-04-19
- 山東大學劉新宇、崔基煒教授交叉團隊 ACS Nano:靶向遞送與肝-骨軸調控協同治療骨質疏松 2025-06-29
