浙大周民教授團隊 Bioact. Mater.:微藻藥物遞送系統(tǒng)"降尿酸-抗炎-消化系統(tǒng)保護"三位一體協(xié)同用于痛風(fēng)性關(guān)節(jié)炎的治療
2025-06-04 來源:高分子科技
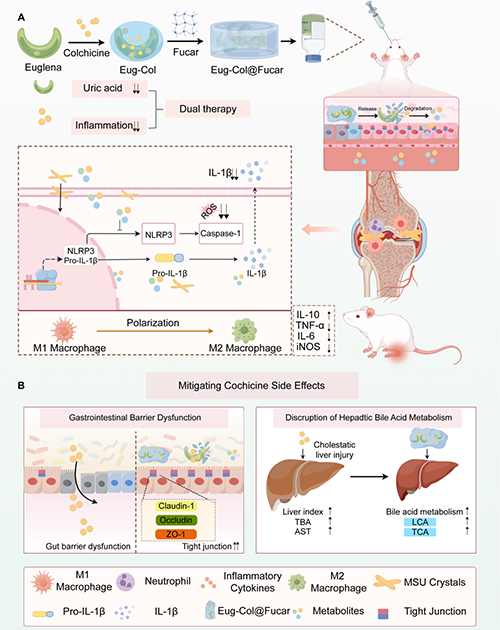
痛風(fēng)性關(guān)節(jié)炎(Gouty Arthritis, GA)是由尿酸代謝異常導(dǎo)致尿酸鹽(MSU)結(jié)晶在關(guān)節(jié)及周圍組織沉積所引發(fā)的炎癥性疾病。該疾病以關(guān)節(jié)劇烈疼痛、腫脹和活動受限為主要臨床表現(xiàn),已成為全球最常見的炎癥性關(guān)節(jié)疾病之一。流行病學(xué)數(shù)據(jù)顯示,過去二十年間其發(fā)病率增長超過兩倍,嚴(yán)重影響患者生活質(zhì)量。當(dāng)前該疾病的臨床治療面臨兩大難題:一線藥物秋水仙堿(Col)雖具有良好的抗炎效果,但其治療劑量接近中毒劑量,約20%患者會出現(xiàn)腹瀉、嘔吐等胃腸道不良反應(yīng);此外,目前尚無藥物能夠同時干預(yù)高尿酸血癥(HUA)和關(guān)節(jié)炎癥兩個病理過程。
針對上述問題,浙江大學(xué)州民教授團隊開發(fā)了一種基于開發(fā)了一種基于裸藻(Eug)、秋水仙堿(Col)和巖藻糖卡拉膠復(fù)合物(Fucar)的口服水凝膠系統(tǒng)(Eug-Col@Fucar) 將裸藻的尿酸吸附特性、巖藻糖卡拉膠復(fù)合物的腸道保護功能與秋水仙堿的抗炎作用有機結(jié)合。首次實現(xiàn)了"降尿酸-抗炎-消化系統(tǒng)保護"三位一體協(xié)同治療,為痛風(fēng)患者提供了更安全高效的治療方案。實驗結(jié)果表明,Eug-Col@Fucar能有效降低血清尿酸水平,清除自由基和活性氧(ROS),促進巨噬細(xì)胞向M2型抗炎表型極化,抑制NLRP3-IL-1β信號通路,從而改善痛風(fēng)性關(guān)節(jié)炎。此外,該系統(tǒng)顯著緩解了秋水仙堿引起的胃腸道不良反應(yīng),如胃腸絨毛結(jié)構(gòu)異常和屏障通透性增加等問題。由于富含多糖成分,該水凝膠系統(tǒng)還能改善膽汁酸代謝,從而減輕秋水仙堿誘導(dǎo)的肝毒性。此外,安全性評估也證實了該復(fù)合物的良好生物相容性,為未來臨床應(yīng)用奠定了基礎(chǔ)。

該文章近期以《Microalgae-based hydrogel drug delivery system for treatment of gouty arthritis with alleviated colchicine side effects》為題發(fā)表于《Bioactive Materials》上。
本研究開發(fā)了一種Eug-Col@Fucar水凝膠系統(tǒng),用于共同傳遞Eug和Col,制得了更加穩(wěn)定和均勻的制劑。該水凝膠通過將巖藻糖(Fuc)與不同濃度的卡拉膠(Car)混合,誘導(dǎo)凝膠化。結(jié)果表明,隨著卡拉膠濃度的增加,水凝膠展現(xiàn)了良好的剪切變稀特性和可注射性,并且凝膠的彈性得到了顯著增強。掃描電子顯微鏡(SEM)圖像顯示,巖藻糖和卡拉膠通過協(xié)同作用形成了致密的凝膠網(wǎng)絡(luò),且隨著卡拉膠濃度的增加,凝膠孔徑減小,從而提高了凝膠的強度和穩(wěn)定性。Eug-Col復(fù)合物成功地被包載進Fucar水凝膠中,并且在加載后水凝膠呈現(xiàn)綠色,顯示出優(yōu)良的可注射性。體外藥物釋放實驗表明,Eug-Col@Fucar能夠有效保護Col免受胃酸的降解,允許在小腸中進行控制釋放,從而提高了Col的生物利用度并減少了胃腸道毒性。總體來說,F(xiàn)ucar水凝膠系統(tǒng)對于Eug和Col的口服遞送是一個有效的載體。
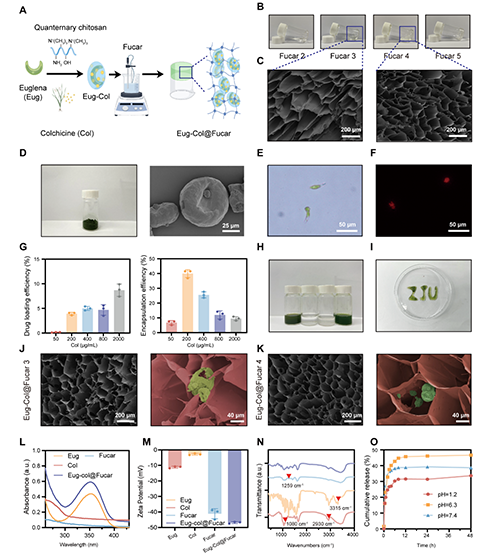 圖1. Eug-Col@Fucar的合成與表征。(A) Eug-Col@Fucar合成示意圖(B)不同濃度的Fucar水凝膠。(C) Fucar 3和Fucar 4的代表性SEM圖像。(D) Eug冷凍照片和Eug的代表性SEM圖像。(E) 代表Eug的亮場和(F)熒光圖像。(G) Eug-Col溶液的載藥效率和包封效率。(H) Eug-Col的照片溶液,Col溶液,F(xiàn)ucar 4水凝膠,Eug-Col@Fucar水凝膠。(I) Eug-Col@Fucar的可注射性。(J) Eug-Col@Fucar具有代表性的SEM圖像低倍放大(左)和高倍放大(右)下。紅色:Fucar。綠色:Eug-Col。(K) Eug-Col@Fucar 4在低放大(左)和高倍放大(右)下的代表性SEM圖像。紅色:Fucar。綠色:Eug-Col。(L) Eug的紫外-可見吸收光譜,(M) Zeta電位,(N) FTIR光譜;Col,F(xiàn)ucar和Eug-Col@Fucar。(O)Eug-Col@Fucar在不同pH值下PBS中的累積Col釋放量。
圖1. Eug-Col@Fucar的合成與表征。(A) Eug-Col@Fucar合成示意圖(B)不同濃度的Fucar水凝膠。(C) Fucar 3和Fucar 4的代表性SEM圖像。(D) Eug冷凍照片和Eug的代表性SEM圖像。(E) 代表Eug的亮場和(F)熒光圖像。(G) Eug-Col溶液的載藥效率和包封效率。(H) Eug-Col的照片溶液,Col溶液,F(xiàn)ucar 4水凝膠,Eug-Col@Fucar水凝膠。(I) Eug-Col@Fucar的可注射性。(J) Eug-Col@Fucar具有代表性的SEM圖像低倍放大(左)和高倍放大(右)下。紅色:Fucar。綠色:Eug-Col。(K) Eug-Col@Fucar 4在低放大(左)和高倍放大(右)下的代表性SEM圖像。紅色:Fucar。綠色:Eug-Col。(L) Eug的紫外-可見吸收光譜,(M) Zeta電位,(N) FTIR光譜;Col,F(xiàn)ucar和Eug-Col@Fucar。(O)Eug-Col@Fucar在不同pH值下PBS中的累積Col釋放量。
(2)Eug-Col@Fucar的體外生物相容性及抗氧化作用
Eug(一種富含抗氧化成分的微藻)與Col(治療痛風(fēng)的臨床藥物)在Fucar水凝膠載體中協(xié)同作用,能夠顯著增強細(xì)胞活力,并減輕Col的細(xì)胞毒性。Eug和Fucar顯示了良好的生物兼容性,并促進了細(xì)胞的增殖。Eug在清除自由基方面表現(xiàn)優(yōu)異,并與Col一起對抗氧化應(yīng)激提供保護。此外,Eug-Col@Fucar系統(tǒng)在體外實驗中有效地清除了過氧化氫和自由基,且在LPS誘導(dǎo)的氧化應(yīng)激中顯著減少了ROS的生成,表現(xiàn)出較強的抗氧化作用。總體而言,Eug-Col@Fucar不僅具有較強的抗氧化能力,還能夠有效減少氧化損傷,具有在治療炎癥性疾病中的應(yīng)用前景。
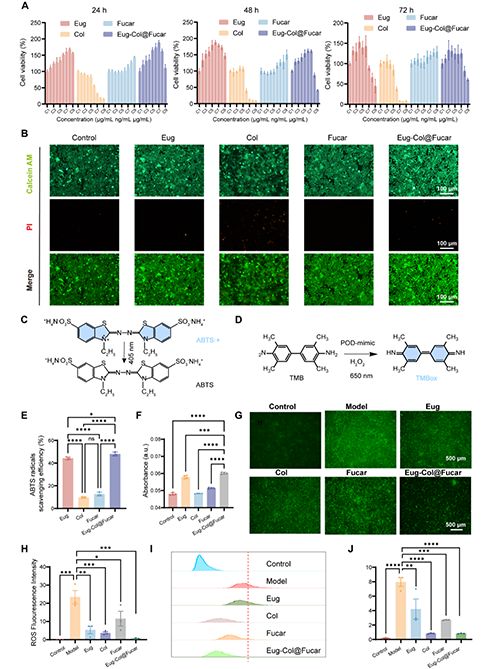 圖2.體外生物相容性及抗氧化作用評價。(A)用CCK8法測定不同濃度的Eug、Col、Fucar和Eug-Col@Fucar處理RAW264.7細(xì)胞24小時、48小時和72小時細(xì)胞活力。(B)用Eug、Col、Fucar和Eug-Col@Fucar處理RAW264.7細(xì)胞24小時的活死染色。(C) ABTS自由基清除實驗示意圖。(D) TMB法檢測過氧化物酶活性示意圖。(E)不同材料對ABTS自由基的清除效率。(F)不同處理后650 nm oxTMB吸光度。(G)不同處理后RAW 264.7細(xì)胞胞內(nèi)ROS生成的DCFH-DA染色。(H) RAW 264.7細(xì)胞胞內(nèi)ROS熒光強度定量。(I)不同處理后RAW 264.7細(xì)胞ROS生成的流式細(xì)胞術(shù)分析。(J)流式細(xì)胞術(shù)分析中平均熒光強度的定量。
圖2.體外生物相容性及抗氧化作用評價。(A)用CCK8法測定不同濃度的Eug、Col、Fucar和Eug-Col@Fucar處理RAW264.7細(xì)胞24小時、48小時和72小時細(xì)胞活力。(B)用Eug、Col、Fucar和Eug-Col@Fucar處理RAW264.7細(xì)胞24小時的活死染色。(C) ABTS自由基清除實驗示意圖。(D) TMB法檢測過氧化物酶活性示意圖。(E)不同材料對ABTS自由基的清除效率。(F)不同處理后650 nm oxTMB吸光度。(G)不同處理后RAW 264.7細(xì)胞胞內(nèi)ROS生成的DCFH-DA染色。(H) RAW 264.7細(xì)胞胞內(nèi)ROS熒光強度定量。(I)不同處理后RAW 264.7細(xì)胞ROS生成的流式細(xì)胞術(shù)分析。(J)流式細(xì)胞術(shù)分析中平均熒光強度的定量。
(3)Eug-Col@Fucar巨噬細(xì)胞重編程和體外抗炎能力的研究
Eug-Col@Fucar系統(tǒng)在治療痛風(fēng)性關(guān)節(jié)炎(GA)中具有潛力。研究表明,Eug-Col@Fucar能夠顯著誘導(dǎo)小鼠巨噬細(xì)胞從M1型(促炎性)轉(zhuǎn)變?yōu)镸2型(抗炎性),并且通過這種轉(zhuǎn)化有效地抑制了炎癥反應(yīng)。實驗中,Eug-Col@Fucar顯著提高了M2型巨噬細(xì)胞的比例,減少了M1型巨噬細(xì)胞的比例,從而降低了與痛風(fēng)相關(guān)的炎癥因子(如TNF-α、IL-6、IL-1β)的表達。與Eug、Col、Fucar單獨處理相比,Eug-Col@Fucar表現(xiàn)出更強的抗炎作用,能夠有效抑制M1型標(biāo)志基因的表達,并增強M2型標(biāo)志基因的表達。因此,Eug-Col@Fucar系統(tǒng)能夠有效重編程巨噬細(xì)胞,轉(zhuǎn)化為抗炎性的M2型巨噬細(xì)胞,為痛風(fēng)性關(guān)節(jié)炎的治療提供了一種理想的生物材料。
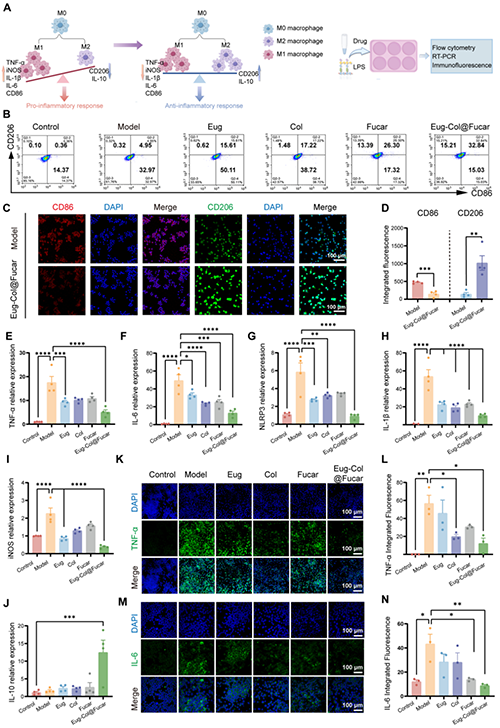 圖3. 巨噬細(xì)胞重編程及體外抗炎能力評價。(A)巨噬細(xì)胞重編程示意圖。(B) Eug、Col、Fucar和Eug-Col@Fucar處理后的M1和M2巨噬細(xì)胞比例的流式細(xì)胞術(shù)分析。(C)免疫熒光染色和(D) Eug-Col@Fucar處理后CD86 (M1標(biāo)記,紅色)和CD206 (M2標(biāo)記,綠色)的定量。(e) qPCR檢測M1巨噬細(xì)胞基因(TNF-α、IL-6、NLRP3、IL-1β和iNOS)的表達。(J) qPCR檢測M2巨噬細(xì)胞基因(IL-10)的表達。(K) 不同處理后TNF-α(綠色)的免疫熒光染色。(L) TNF-α的相對熒光強度定量。(M)不同處理后IL-6(綠色)的免疫熒光染色。(N)定量IL-6的相對熒光強度。
圖3. 巨噬細(xì)胞重編程及體外抗炎能力評價。(A)巨噬細(xì)胞重編程示意圖。(B) Eug、Col、Fucar和Eug-Col@Fucar處理后的M1和M2巨噬細(xì)胞比例的流式細(xì)胞術(shù)分析。(C)免疫熒光染色和(D) Eug-Col@Fucar處理后CD86 (M1標(biāo)記,紅色)和CD206 (M2標(biāo)記,綠色)的定量。(e) qPCR檢測M1巨噬細(xì)胞基因(TNF-α、IL-6、NLRP3、IL-1β和iNOS)的表達。(J) qPCR檢測M2巨噬細(xì)胞基因(IL-10)的表達。(K) 不同處理后TNF-α(綠色)的免疫熒光染色。(L) TNF-α的相對熒光強度定量。(M)不同處理后IL-6(綠色)的免疫熒光染色。(N)定量IL-6的相對熒光強度。
(4)Eug-Col@Fucar的熒光成像性質(zhì)及生物分布
Eug-Col@Fucar在口服給藥后的生物分布研究表明,該復(fù)合材料能夠有效延長藥物在體內(nèi)的滯留時間,促進藥物的吸收并增強治療效果。通過熒光成像觀察發(fā)現(xiàn),Eug-Col@Fucar主要分布在小腸,尤其是回腸,并且在24小時內(nèi),Eug-Col@Fucar在小腸的熒光信號強度和持續(xù)時間顯著高于自由的Eug和Col。此外,未在主要器官(如心臟、肝臟、脾臟、肺和腎臟)中檢測到Eug積聚,說明Eug-Col@Fucar在口服后主要在胃腸道內(nèi)發(fā)揮作用。通過定量分析發(fā)現(xiàn),雖然Fucar涂層使FITC的熒光強度有所降低,但Eug-Col@Fucar組在24小時后的信號更為顯著,表明Col的滯留時間得到了延長。凍切片的腸道組織進一步證明了Eug-Col@Fucar能夠有效地保持Eug和Col的熒光信號,且與單獨使用Eug和Col的組相比,表現(xiàn)出更強的熒光。在降解過程方面,Eug-Col@Fucar在胃腸道內(nèi)表現(xiàn)出優(yōu)異的生物降解性。其在小腸和盲腸逐漸解體,到達結(jié)腸時幾乎完全降解,證明了其良好的生物可降解性。綜上所述,Eug-Col@Fucar能夠有效延長藥物在體內(nèi)的滯留時間,增強藥物吸收,并且具有優(yōu)異的生物降解性,顯示出其作為口服給藥系統(tǒng)的潛力。
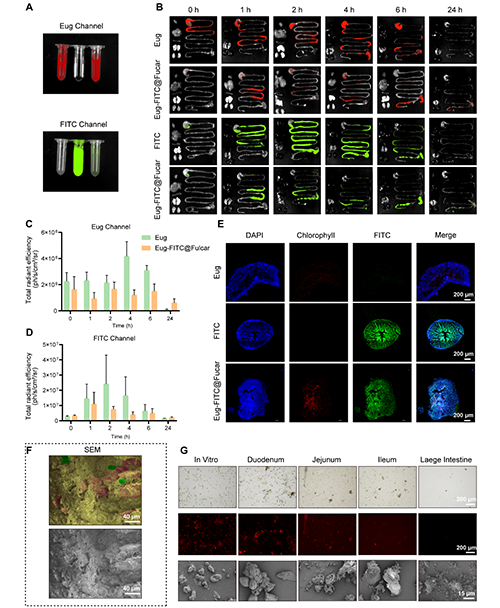 圖4. Eug-FITC@Fucar的熒光成像及生物分布。(A) 在Eug通道和FITC通道下,F(xiàn)ITC、Eug和Eug-FITC@Fucar的體外熒光成像(B) 分別在Eug通道和FITC通道下口服FITC、Eug或Eug-FITC@Fucar(等量FITC或Eug) 0、1、2、4、6和24小時小鼠主要器官(心、肝、脾、肺、腎和胃腸道)的代表性熒光圖像。(C) Eug通道和(D) FITC通道下各時間點的熒光定量。(E) 小鼠灌胃后。Eug 、FITC和Eug-FITC@Fucar后同一位置腸道組織冷凍切片的代表性熒光圖像。(F) 灌胃Eug-Col@Fucar后小鼠腸道組織代表性SEM(下)和偽彩色SEM(上)圖像。(G) 小鼠胃腸道不同部位內(nèi)容物代表性亮場顯微鏡圖像(上)、熒光圖像(中)和SEM圖像(下)。
圖4. Eug-FITC@Fucar的熒光成像及生物分布。(A) 在Eug通道和FITC通道下,F(xiàn)ITC、Eug和Eug-FITC@Fucar的體外熒光成像(B) 分別在Eug通道和FITC通道下口服FITC、Eug或Eug-FITC@Fucar(等量FITC或Eug) 0、1、2、4、6和24小時小鼠主要器官(心、肝、脾、肺、腎和胃腸道)的代表性熒光圖像。(C) Eug通道和(D) FITC通道下各時間點的熒光定量。(E) 小鼠灌胃后。Eug 、FITC和Eug-FITC@Fucar后同一位置腸道組織冷凍切片的代表性熒光圖像。(F) 灌胃Eug-Col@Fucar后小鼠腸道組織代表性SEM(下)和偽彩色SEM(上)圖像。(G) 小鼠胃腸道不同部位內(nèi)容物代表性亮場顯微鏡圖像(上)、熒光圖像(中)和SEM圖像(下)。
(5)Eug-Col@Fucar治療急性痛風(fēng)性關(guān)節(jié)炎的療效
Eug-Col@Fucar在高尿酸血癥(HUA)誘導(dǎo)的痛風(fēng)性關(guān)節(jié)炎(GA)小鼠模型中表現(xiàn)出了顯著的治療效果。與模型組相比,Eug-Col@Fucar組在減輕關(guān)節(jié)腫脹、緩解機械性痛覺過敏、改善步態(tài)以及減輕骨損傷方面表現(xiàn)更為顯著。特別是,Eug-Col@Fucar組在48小時后,關(guān)節(jié)腫脹程度與對照組相近,遠(yuǎn)優(yōu)于單獨使用Eug、Col和Fucar的組。此外,Eug-Col@Fucar組的尿酸水平顯著低于模型組,而Col組的尿酸水平未能顯著降低。Eug-Col@Fucar通過持續(xù)釋放Eug和Col,有效減輕了由MSU結(jié)晶引起的痛風(fēng)性關(guān)節(jié)炎的癥狀,并改善了小鼠的步態(tài)障礙。Micro CT分析顯示,Eug-Col@Fucar組在關(guān)節(jié)骨損傷方面明顯優(yōu)于模型組,證明其具有保護骨骼的作用。總的來說,Eug-Col@Fucar不僅能夠降低血清尿酸濃度,還能減輕關(guān)節(jié)炎癥、緩解痛感、改善步態(tài)障礙,并具有潛力作為治療痛風(fēng)性關(guān)節(jié)炎的雙重療法。
 圖5. Eug-Col@Fucar對MSU誘導(dǎo)GA伴HUA的治療作用。(A) 治療過程示意圖。(B) 注射后6、24、48 h,不同治療組GA小鼠右腳踝代表性照片。(C) PBS、Eug、Col、Fucar和Eug-Col@Fucar在關(guān)鍵時間點(2、4、6、24和48 h) GA小鼠關(guān)節(jié)直徑的變化。(D) 處理期間小鼠體重。(E) 用Eug、Col、Fucar和Eug-Col@Fucar處理的HUA小鼠血清UA水平。(F) 不同組分別在6 h和24 h的步態(tài)分析結(jié)果。虛線表示步幅。(G) 定量分析不同組痛風(fēng)性關(guān)節(jié)炎小鼠在6 h和24 h時的相對步長。(H) 對照組、模型組、Eug組、Col組、Fucar組和Eug-Col@Fucar組50% PWT分別在6 h和24 h時的變化。(I) 對照組、模型組和Eug-Col@Fucar組踝關(guān)節(jié)代表性顯微CT圖像。
圖5. Eug-Col@Fucar對MSU誘導(dǎo)GA伴HUA的治療作用。(A) 治療過程示意圖。(B) 注射后6、24、48 h,不同治療組GA小鼠右腳踝代表性照片。(C) PBS、Eug、Col、Fucar和Eug-Col@Fucar在關(guān)鍵時間點(2、4、6、24和48 h) GA小鼠關(guān)節(jié)直徑的變化。(D) 處理期間小鼠體重。(E) 用Eug、Col、Fucar和Eug-Col@Fucar處理的HUA小鼠血清UA水平。(F) 不同組分別在6 h和24 h的步態(tài)分析結(jié)果。虛線表示步幅。(G) 定量分析不同組痛風(fēng)性關(guān)節(jié)炎小鼠在6 h和24 h時的相對步長。(H) 對照組、模型組、Eug組、Col組、Fucar組和Eug-Col@Fucar組50% PWT分別在6 h和24 h時的變化。(I) 對照組、模型組和Eug-Col@Fucar組踝關(guān)節(jié)代表性顯微CT圖像。
(6)對MSU誘導(dǎo)的氧化應(yīng)激和NLRP3介導(dǎo)的體內(nèi)炎癥的抑制作用
Eug-Col@Fucar的抗炎效果:Eug-Col@Fucar顯著減少了痛風(fēng)性關(guān)節(jié)炎(GA)小鼠模型中關(guān)節(jié)的中性粒細(xì)胞和M1型巨噬細(xì)胞的數(shù)量,表現(xiàn)出強大的抗炎潛力。與模型組相比,Eug-Col@Fucar組在減輕炎癥和細(xì)胞浸潤方面效果顯著。Eug-Col@Fucar通過顯著減少NLRP3炎癥小體的表達,抑制了MSU結(jié)晶引起的炎癥反應(yīng)。Western blot分析顯示,Eug-Col@Fucar顯著降低了NLRP3、活化的Caspase-1、ASC和IL-1β的過度表達,證明其對NLRP3炎癥小體的抑制作用。
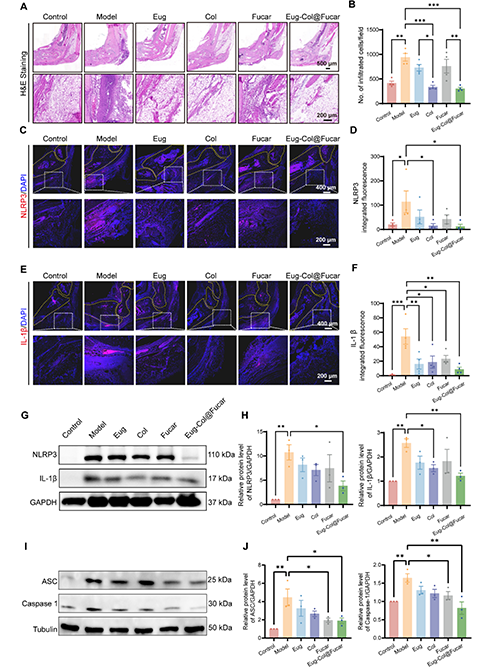 圖6. Eug-Col@Fucar對踝關(guān)節(jié)的抗炎作用。(A) 低倍放大(上)和高倍放大(下)踝關(guān)節(jié)H&E染色。(B)每個觀察場浸潤炎性細(xì)胞數(shù)的陽性分析。(C) 低(上)和高(下)放大下踝關(guān)節(jié)NLRP3的免疫熒光染色。(D) 踝關(guān)節(jié)NLRP3熒光定量分析。(E)低倍放大(上)和高倍放大(下)踝關(guān)節(jié)IL-1β免疫熒光染色。(F) 踝關(guān)節(jié)組織IL-1β熒光定量分析。(G) 不同處理后踝關(guān)節(jié)組織NLRP3和IL-1β水平的Western blot分析。(H) 踝關(guān)節(jié)組織中IL-1β和NLRP3蛋白水平的定量分析。(I) 不同處理后踝關(guān)節(jié)組織中ASC和Caspase 1蛋白水平的Western blot分析。(J) 踝關(guān)節(jié)組織中ASC和Caspase 1蛋白水平的定量分析。
圖6. Eug-Col@Fucar對踝關(guān)節(jié)的抗炎作用。(A) 低倍放大(上)和高倍放大(下)踝關(guān)節(jié)H&E染色。(B)每個觀察場浸潤炎性細(xì)胞數(shù)的陽性分析。(C) 低(上)和高(下)放大下踝關(guān)節(jié)NLRP3的免疫熒光染色。(D) 踝關(guān)節(jié)NLRP3熒光定量分析。(E)低倍放大(上)和高倍放大(下)踝關(guān)節(jié)IL-1β免疫熒光染色。(F) 踝關(guān)節(jié)組織IL-1β熒光定量分析。(G) 不同處理后踝關(guān)節(jié)組織NLRP3和IL-1β水平的Western blot分析。(H) 踝關(guān)節(jié)組織中IL-1β和NLRP3蛋白水平的定量分析。(I) 不同處理后踝關(guān)節(jié)組織中ASC和Caspase 1蛋白水平的Western blot分析。(J) 踝關(guān)節(jié)組織中ASC和Caspase 1蛋白水平的定量分析。
(7)對秋水仙堿相關(guān)不良反應(yīng)的保護作用
Col的毒性與副作用:Col的治療劑量接近其毒性劑量,最常見的毒性表現(xiàn)為胃腸道副作用,如惡心、嘔吐和腹瀉。在GA治療過程中,Col處理的小鼠體重顯著下降,這可能與其毒性相關(guān)。Col處理導(dǎo)致胃和肝臟的器官指數(shù)顯著增加,提示可能引起胃和肝臟組織的病理改變。而在將Col與Fucar共同封裝形成Eug-Col@Fucar后,這兩者的器官指數(shù)恢復(fù)正常,表明Eug-Col@Fucar能夠減輕Col對胃和肝臟的損傷。Col處理導(dǎo)致結(jié)腸長度縮短,并顯著減少了緊密連接蛋白Occludin、Claudin-1和ZO-1的表達,表明Col可能損害了腸道屏障功能。而Eug-Col@Fucar能夠顯著恢復(fù)這些緊密連接蛋白的表達,修復(fù)腸道屏障功能。Col組的小鼠胃粘膜上皮細(xì)胞喪失,結(jié)腸組織的杯狀細(xì)胞分泌減少,導(dǎo)致結(jié)腸屏障通透性增加。此外,Col處理還導(dǎo)致肝細(xì)胞輕微的顆粒變形和細(xì)胞質(zhì)松弛。通過HE染色可以看到,Col引起的這些胃腸道和肝臟損傷在Eug-Col@Fucar的治療下得到了明顯改善。
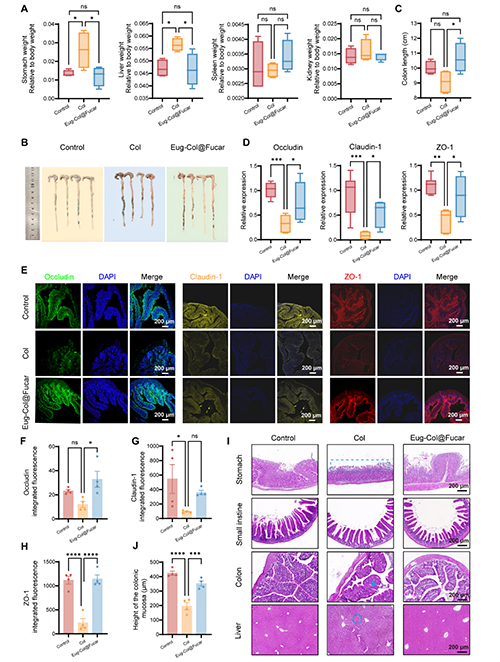 圖7. Eug-Col@Fucar減少秋水仙堿的胃腸道副作用。(A)在Control、Col、和Eug-Col@Fucar組的主要器官的器官指數(shù),包括肝、胃、脾、腎。(B)不同組小鼠盲腸和結(jié)腸組織中的解剖照片。(C) 結(jié)腸長度定量。(D) RT-qPCR 分析Occludin, Claudin-1,和ZO-1表達水平。(E) ,不同組小鼠結(jié)腸組織Occludin(綠色)的Claudin-1(黃色)和ZO-1(紅色)的熒光圖片。不同處理后結(jié)腸組織(F) Occludin、(G) Claudin-1、(H) ZO-1熒光定量分析。(I) Control組、Col組、Eug-Col@Fucar組結(jié)腸黏膜高度定量分析(n = 4)。(J)不同組胃、小腸、結(jié)腸、肝臟組織代表性H&E染色圖像。
圖7. Eug-Col@Fucar減少秋水仙堿的胃腸道副作用。(A)在Control、Col、和Eug-Col@Fucar組的主要器官的器官指數(shù),包括肝、胃、脾、腎。(B)不同組小鼠盲腸和結(jié)腸組織中的解剖照片。(C) 結(jié)腸長度定量。(D) RT-qPCR 分析Occludin, Claudin-1,和ZO-1表達水平。(E) ,不同組小鼠結(jié)腸組織Occludin(綠色)的Claudin-1(黃色)和ZO-1(紅色)的熒光圖片。不同處理后結(jié)腸組織(F) Occludin、(G) Claudin-1、(H) ZO-1熒光定量分析。(I) Control組、Col組、Eug-Col@Fucar組結(jié)腸黏膜高度定量分析(n = 4)。(J)不同組胃、小腸、結(jié)腸、肝臟組織代表性H&E染色圖像。
(8)調(diào)節(jié)膽汁酸代謝
Col(生物堿)通過影響膽汁酸的代謝,引起了肝臟損傷和膽汁淤積。Col治療導(dǎo)致膽汁酸的積累,特別是石膽酸(LCA)和牛磺酸鞘磷脂酸鈉(TCA)的水平顯著增加,這與肝毒性相關(guān)。LCA在體內(nèi)過量時,能夠干擾膽汁酸的轉(zhuǎn)運,導(dǎo)致膽汁酸在肝臟中的積累,從而引發(fā)肝臟損傷。
然而,Eug-Col@Fucar(由Fucar和Eug組成的復(fù)合物)能夠部分緩解Col引起的膽汁淤積。Eug-Col@Fucar通過調(diào)節(jié)膽汁酸相關(guān)受體的表達,促進膽汁酸代謝,改善膽汁酸的分泌,減輕肝臟損傷。因此,Eug-Col@Fucar在調(diào)節(jié)膽汁酸代謝和改善肝功能方面顯示出一定的治療潛力。
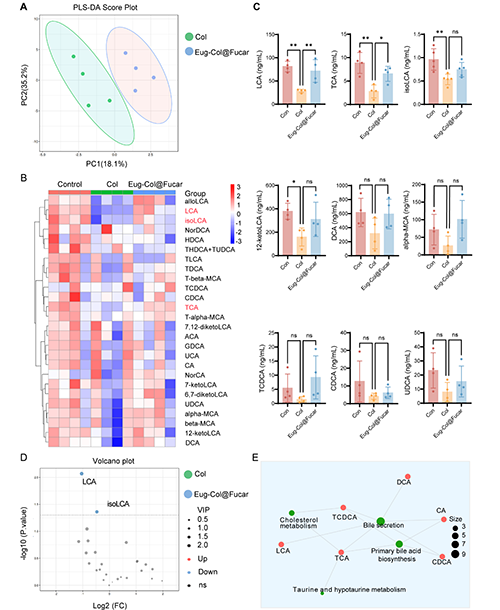 圖8. Eug-Col@Fucar恢復(fù)膽汁酸代謝物譜。(A) Control組、Col組和Eug-Col@Fucar組的PLS-DA評分圖。(B) 不同組膽汁酸相對豐度的群落熱圖分析。(C) 不同組糞便中LCA、TCA、α - mca、isoLCA、12-ketoLCA、DCA、TDCA、CDCA和UDCA的濃度。(D) 火山圖反映了Col組和Eug-Col@Fucar組之間代謝物的差異。(E) 對照組、Col組和Eug-Col@Fucar組差異代謝物的KEGG通路富集分析。
圖8. Eug-Col@Fucar恢復(fù)膽汁酸代謝物譜。(A) Control組、Col組和Eug-Col@Fucar組的PLS-DA評分圖。(B) 不同組膽汁酸相對豐度的群落熱圖分析。(C) 不同組糞便中LCA、TCA、α - mca、isoLCA、12-ketoLCA、DCA、TDCA、CDCA和UDCA的濃度。(D) 火山圖反映了Col組和Eug-Col@Fucar組之間代謝物的差異。(E) 對照組、Col組和Eug-Col@Fucar組差異代謝物的KEGG通路富集分析。
(9)調(diào)節(jié)膽汁酸代謝
通過口服給藥Eug、Col、Fucar和Eug-Col@Fucar,并進行血液和組織學(xué)分析,研究評估了體內(nèi)生物相容性。各組的常規(guī)血液分析參數(shù)均在正常范圍內(nèi),治療組與健康對照組之間沒有顯著差異。然而,Col組在兩個肝功能指標(biāo)(TBA和ALT)上出現(xiàn)了顯著差異,特別是TBA含量的增加與膽汁酸代謝分析的結(jié)果一致,表明長期使用Col可能導(dǎo)致膽汁酸在肝臟中的積累。此外,心臟、脾臟、肺和腎臟的組織切片中未發(fā)現(xiàn)明顯的損傷或病理變化。Col組肝臟出現(xiàn)輕度的肝細(xì)胞水腫和變性,而其他組的肝臟未見明顯病理變化。結(jié)果表明,F(xiàn)ucar二元多糖水凝膠能夠有效減少Col的長期毒性。
 圖9. 口服生物安全性評價Eug-Col@Fucar。(A)不同處理后小鼠血常規(guī)及生化分析(n = 5)。白細(xì)胞(WBC);紅細(xì)胞;血紅蛋白,血紅蛋白;MCV,平均細(xì)胞體積;MCH,平均紅細(xì)胞血紅蛋白;MCHC,平均紅細(xì)胞血紅蛋白濃度;HCT、血細(xì)胞比容;RDW,紅細(xì)胞分布寬度;PLT:血小板;MPV,平均血小板體積;TBA:總膽汁酸;谷草轉(zhuǎn)氨酶。(B)主要臟器(心、肝、脾、肺、腎)的H&E染色。
圖9. 口服生物安全性評價Eug-Col@Fucar。(A)不同處理后小鼠血常規(guī)及生化分析(n = 5)。白細(xì)胞(WBC);紅細(xì)胞;血紅蛋白,血紅蛋白;MCV,平均細(xì)胞體積;MCH,平均紅細(xì)胞血紅蛋白;MCHC,平均紅細(xì)胞血紅蛋白濃度;HCT、血細(xì)胞比容;RDW,紅細(xì)胞分布寬度;PLT:血小板;MPV,平均血小板體積;TBA:總膽汁酸;谷草轉(zhuǎn)氨酶。(B)主要臟器(心、肝、脾、肺、腎)的H&E染色。
本研究成功開發(fā)了Eug-Col@Fucar水凝膠系統(tǒng),該系統(tǒng)利用Fucar載載Eug-Col復(fù)合物。該水凝膠系統(tǒng)有效減少了細(xì)胞毒性,清除自由基和活性氧,促進了細(xì)胞向M2型抗炎表型的極化,并抑制了炎癥因子的釋放。此外,Eug-Col@Fucar水凝膠通過在腸道環(huán)境中持續(xù)釋放藥物,顯著提高了藥物的口服生物利用度。同時,Eug-Col@Fucar通過抑制NLRP3-IL1β途徑,穩(wěn)定并增強了抗炎效果。因此,重編程的抗炎微環(huán)境有效抑制了炎癥反應(yīng),緩解了GA小鼠的踝關(guān)節(jié)腫脹和關(guān)節(jié)疼痛。此外,Eug-Col@Fucar有效緩解了Col引起的胃腸副作用,如胃腸組織緊密連接受損和胃絨毛喪失。由于其富含多糖的組成,Eug-Col@Fucar水凝膠系統(tǒng)還改善了膽汁酸代謝,從而減輕了Col引起的肝毒性。除了顯著的療效外,Eug-Col@Fucar還表現(xiàn)出優(yōu)異的生物安全性,適合長期應(yīng)用。總之,本研究開發(fā)了一種新型水凝膠遞送系統(tǒng),能夠增強藥物在GA治療中的療效,同時減輕Col長期臨床應(yīng)用所帶來的不良反應(yīng)。Eug-Col@Fucar為GA治療提供了一種有前景的策略,并具有廣泛的臨床應(yīng)用潛力。
論文第一作者為浙江大學(xué)博士生劉笑陽和浙江大學(xué)愛丁堡大學(xué)聯(lián)合學(xué)院博士后董佳,浙江大學(xué)周民教授為論文的通訊作者。上述研究得到了國家重點研發(fā)計劃項目、浙江省領(lǐng)軍創(chuàng)新創(chuàng)業(yè)團隊引進計劃等基金項目的大力支持。
全文鏈接:https://www.sciencedirect.com/science/article/pii/S2452199X25002154
針對上述問題,浙江大學(xué)州民教授團隊開發(fā)了一種基于開發(fā)了一種基于裸藻(Eug)、秋水仙堿(Col)和巖藻糖卡拉膠復(fù)合物(Fucar)的口服水凝膠系統(tǒng)(Eug-Col@Fucar) 將裸藻的尿酸吸附特性、巖藻糖卡拉膠復(fù)合物的腸道保護功能與秋水仙堿的抗炎作用有機結(jié)合。首次實現(xiàn)了"降尿酸-抗炎-消化系統(tǒng)保護"三位一體協(xié)同治療,為痛風(fēng)患者提供了更安全高效的治療方案。實驗結(jié)果表明,Eug-Col@Fucar能有效降低血清尿酸水平,清除自由基和活性氧(ROS),促進巨噬細(xì)胞向M2型抗炎表型極化,抑制NLRP3-IL-1β信號通路,從而改善痛風(fēng)性關(guān)節(jié)炎。此外,該系統(tǒng)顯著緩解了秋水仙堿引起的胃腸道不良反應(yīng),如胃腸絨毛結(jié)構(gòu)異常和屏障通透性增加等問題。由于富含多糖成分,該水凝膠系統(tǒng)還能改善膽汁酸代謝,從而減輕秋水仙堿誘導(dǎo)的肝毒性。此外,安全性評估也證實了該復(fù)合物的良好生物相容性,為未來臨床應(yīng)用奠定了基礎(chǔ)。

該文章近期以《Microalgae-based hydrogel drug delivery system for treatment of gouty arthritis with alleviated colchicine side effects》為題發(fā)表于《Bioactive Materials》上。

(1)Eug-Col@Fucar的合成和表征
本研究開發(fā)了一種Eug-Col@Fucar水凝膠系統(tǒng),用于共同傳遞Eug和Col,制得了更加穩(wěn)定和均勻的制劑。該水凝膠通過將巖藻糖(Fuc)與不同濃度的卡拉膠(Car)混合,誘導(dǎo)凝膠化。結(jié)果表明,隨著卡拉膠濃度的增加,水凝膠展現(xiàn)了良好的剪切變稀特性和可注射性,并且凝膠的彈性得到了顯著增強。掃描電子顯微鏡(SEM)圖像顯示,巖藻糖和卡拉膠通過協(xié)同作用形成了致密的凝膠網(wǎng)絡(luò),且隨著卡拉膠濃度的增加,凝膠孔徑減小,從而提高了凝膠的強度和穩(wěn)定性。Eug-Col復(fù)合物成功地被包載進Fucar水凝膠中,并且在加載后水凝膠呈現(xiàn)綠色,顯示出優(yōu)良的可注射性。體外藥物釋放實驗表明,Eug-Col@Fucar能夠有效保護Col免受胃酸的降解,允許在小腸中進行控制釋放,從而提高了Col的生物利用度并減少了胃腸道毒性。總體來說,F(xiàn)ucar水凝膠系統(tǒng)對于Eug和Col的口服遞送是一個有效的載體。

(2)Eug-Col@Fucar的體外生物相容性及抗氧化作用
Eug(一種富含抗氧化成分的微藻)與Col(治療痛風(fēng)的臨床藥物)在Fucar水凝膠載體中協(xié)同作用,能夠顯著增強細(xì)胞活力,并減輕Col的細(xì)胞毒性。Eug和Fucar顯示了良好的生物兼容性,并促進了細(xì)胞的增殖。Eug在清除自由基方面表現(xiàn)優(yōu)異,并與Col一起對抗氧化應(yīng)激提供保護。此外,Eug-Col@Fucar系統(tǒng)在體外實驗中有效地清除了過氧化氫和自由基,且在LPS誘導(dǎo)的氧化應(yīng)激中顯著減少了ROS的生成,表現(xiàn)出較強的抗氧化作用。總體而言,Eug-Col@Fucar不僅具有較強的抗氧化能力,還能夠有效減少氧化損傷,具有在治療炎癥性疾病中的應(yīng)用前景。

(3)Eug-Col@Fucar巨噬細(xì)胞重編程和體外抗炎能力的研究
Eug-Col@Fucar系統(tǒng)在治療痛風(fēng)性關(guān)節(jié)炎(GA)中具有潛力。研究表明,Eug-Col@Fucar能夠顯著誘導(dǎo)小鼠巨噬細(xì)胞從M1型(促炎性)轉(zhuǎn)變?yōu)镸2型(抗炎性),并且通過這種轉(zhuǎn)化有效地抑制了炎癥反應(yīng)。實驗中,Eug-Col@Fucar顯著提高了M2型巨噬細(xì)胞的比例,減少了M1型巨噬細(xì)胞的比例,從而降低了與痛風(fēng)相關(guān)的炎癥因子(如TNF-α、IL-6、IL-1β)的表達。與Eug、Col、Fucar單獨處理相比,Eug-Col@Fucar表現(xiàn)出更強的抗炎作用,能夠有效抑制M1型標(biāo)志基因的表達,并增強M2型標(biāo)志基因的表達。因此,Eug-Col@Fucar系統(tǒng)能夠有效重編程巨噬細(xì)胞,轉(zhuǎn)化為抗炎性的M2型巨噬細(xì)胞,為痛風(fēng)性關(guān)節(jié)炎的治療提供了一種理想的生物材料。

(4)Eug-Col@Fucar的熒光成像性質(zhì)及生物分布
Eug-Col@Fucar在口服給藥后的生物分布研究表明,該復(fù)合材料能夠有效延長藥物在體內(nèi)的滯留時間,促進藥物的吸收并增強治療效果。通過熒光成像觀察發(fā)現(xiàn),Eug-Col@Fucar主要分布在小腸,尤其是回腸,并且在24小時內(nèi),Eug-Col@Fucar在小腸的熒光信號強度和持續(xù)時間顯著高于自由的Eug和Col。此外,未在主要器官(如心臟、肝臟、脾臟、肺和腎臟)中檢測到Eug積聚,說明Eug-Col@Fucar在口服后主要在胃腸道內(nèi)發(fā)揮作用。通過定量分析發(fā)現(xiàn),雖然Fucar涂層使FITC的熒光強度有所降低,但Eug-Col@Fucar組在24小時后的信號更為顯著,表明Col的滯留時間得到了延長。凍切片的腸道組織進一步證明了Eug-Col@Fucar能夠有效地保持Eug和Col的熒光信號,且與單獨使用Eug和Col的組相比,表現(xiàn)出更強的熒光。在降解過程方面,Eug-Col@Fucar在胃腸道內(nèi)表現(xiàn)出優(yōu)異的生物降解性。其在小腸和盲腸逐漸解體,到達結(jié)腸時幾乎完全降解,證明了其良好的生物可降解性。綜上所述,Eug-Col@Fucar能夠有效延長藥物在體內(nèi)的滯留時間,增強藥物吸收,并且具有優(yōu)異的生物降解性,顯示出其作為口服給藥系統(tǒng)的潛力。

(5)Eug-Col@Fucar治療急性痛風(fēng)性關(guān)節(jié)炎的療效
Eug-Col@Fucar在高尿酸血癥(HUA)誘導(dǎo)的痛風(fēng)性關(guān)節(jié)炎(GA)小鼠模型中表現(xiàn)出了顯著的治療效果。與模型組相比,Eug-Col@Fucar組在減輕關(guān)節(jié)腫脹、緩解機械性痛覺過敏、改善步態(tài)以及減輕骨損傷方面表現(xiàn)更為顯著。特別是,Eug-Col@Fucar組在48小時后,關(guān)節(jié)腫脹程度與對照組相近,遠(yuǎn)優(yōu)于單獨使用Eug、Col和Fucar的組。此外,Eug-Col@Fucar組的尿酸水平顯著低于模型組,而Col組的尿酸水平未能顯著降低。Eug-Col@Fucar通過持續(xù)釋放Eug和Col,有效減輕了由MSU結(jié)晶引起的痛風(fēng)性關(guān)節(jié)炎的癥狀,并改善了小鼠的步態(tài)障礙。Micro CT分析顯示,Eug-Col@Fucar組在關(guān)節(jié)骨損傷方面明顯優(yōu)于模型組,證明其具有保護骨骼的作用。總的來說,Eug-Col@Fucar不僅能夠降低血清尿酸濃度,還能減輕關(guān)節(jié)炎癥、緩解痛感、改善步態(tài)障礙,并具有潛力作為治療痛風(fēng)性關(guān)節(jié)炎的雙重療法。

(6)對MSU誘導(dǎo)的氧化應(yīng)激和NLRP3介導(dǎo)的體內(nèi)炎癥的抑制作用
Eug-Col@Fucar的抗炎效果:Eug-Col@Fucar顯著減少了痛風(fēng)性關(guān)節(jié)炎(GA)小鼠模型中關(guān)節(jié)的中性粒細(xì)胞和M1型巨噬細(xì)胞的數(shù)量,表現(xiàn)出強大的抗炎潛力。與模型組相比,Eug-Col@Fucar組在減輕炎癥和細(xì)胞浸潤方面效果顯著。Eug-Col@Fucar通過顯著減少NLRP3炎癥小體的表達,抑制了MSU結(jié)晶引起的炎癥反應(yīng)。Western blot分析顯示,Eug-Col@Fucar顯著降低了NLRP3、活化的Caspase-1、ASC和IL-1β的過度表達,證明其對NLRP3炎癥小體的抑制作用。

(7)對秋水仙堿相關(guān)不良反應(yīng)的保護作用
Col的毒性與副作用:Col的治療劑量接近其毒性劑量,最常見的毒性表現(xiàn)為胃腸道副作用,如惡心、嘔吐和腹瀉。在GA治療過程中,Col處理的小鼠體重顯著下降,這可能與其毒性相關(guān)。Col處理導(dǎo)致胃和肝臟的器官指數(shù)顯著增加,提示可能引起胃和肝臟組織的病理改變。而在將Col與Fucar共同封裝形成Eug-Col@Fucar后,這兩者的器官指數(shù)恢復(fù)正常,表明Eug-Col@Fucar能夠減輕Col對胃和肝臟的損傷。Col處理導(dǎo)致結(jié)腸長度縮短,并顯著減少了緊密連接蛋白Occludin、Claudin-1和ZO-1的表達,表明Col可能損害了腸道屏障功能。而Eug-Col@Fucar能夠顯著恢復(fù)這些緊密連接蛋白的表達,修復(fù)腸道屏障功能。Col組的小鼠胃粘膜上皮細(xì)胞喪失,結(jié)腸組織的杯狀細(xì)胞分泌減少,導(dǎo)致結(jié)腸屏障通透性增加。此外,Col處理還導(dǎo)致肝細(xì)胞輕微的顆粒變形和細(xì)胞質(zhì)松弛。通過HE染色可以看到,Col引起的這些胃腸道和肝臟損傷在Eug-Col@Fucar的治療下得到了明顯改善。

(8)調(diào)節(jié)膽汁酸代謝
Col(生物堿)通過影響膽汁酸的代謝,引起了肝臟損傷和膽汁淤積。Col治療導(dǎo)致膽汁酸的積累,特別是石膽酸(LCA)和牛磺酸鞘磷脂酸鈉(TCA)的水平顯著增加,這與肝毒性相關(guān)。LCA在體內(nèi)過量時,能夠干擾膽汁酸的轉(zhuǎn)運,導(dǎo)致膽汁酸在肝臟中的積累,從而引發(fā)肝臟損傷。
然而,Eug-Col@Fucar(由Fucar和Eug組成的復(fù)合物)能夠部分緩解Col引起的膽汁淤積。Eug-Col@Fucar通過調(diào)節(jié)膽汁酸相關(guān)受體的表達,促進膽汁酸代謝,改善膽汁酸的分泌,減輕肝臟損傷。因此,Eug-Col@Fucar在調(diào)節(jié)膽汁酸代謝和改善肝功能方面顯示出一定的治療潛力。

(9)調(diào)節(jié)膽汁酸代謝
通過口服給藥Eug、Col、Fucar和Eug-Col@Fucar,并進行血液和組織學(xué)分析,研究評估了體內(nèi)生物相容性。各組的常規(guī)血液分析參數(shù)均在正常范圍內(nèi),治療組與健康對照組之間沒有顯著差異。然而,Col組在兩個肝功能指標(biāo)(TBA和ALT)上出現(xiàn)了顯著差異,特別是TBA含量的增加與膽汁酸代謝分析的結(jié)果一致,表明長期使用Col可能導(dǎo)致膽汁酸在肝臟中的積累。此外,心臟、脾臟、肺和腎臟的組織切片中未發(fā)現(xiàn)明顯的損傷或病理變化。Col組肝臟出現(xiàn)輕度的肝細(xì)胞水腫和變性,而其他組的肝臟未見明顯病理變化。結(jié)果表明,F(xiàn)ucar二元多糖水凝膠能夠有效減少Col的長期毒性。

本研究成功開發(fā)了Eug-Col@Fucar水凝膠系統(tǒng),該系統(tǒng)利用Fucar載載Eug-Col復(fù)合物。該水凝膠系統(tǒng)有效減少了細(xì)胞毒性,清除自由基和活性氧,促進了細(xì)胞向M2型抗炎表型的極化,并抑制了炎癥因子的釋放。此外,Eug-Col@Fucar水凝膠通過在腸道環(huán)境中持續(xù)釋放藥物,顯著提高了藥物的口服生物利用度。同時,Eug-Col@Fucar通過抑制NLRP3-IL1β途徑,穩(wěn)定并增強了抗炎效果。因此,重編程的抗炎微環(huán)境有效抑制了炎癥反應(yīng),緩解了GA小鼠的踝關(guān)節(jié)腫脹和關(guān)節(jié)疼痛。此外,Eug-Col@Fucar有效緩解了Col引起的胃腸副作用,如胃腸組織緊密連接受損和胃絨毛喪失。由于其富含多糖的組成,Eug-Col@Fucar水凝膠系統(tǒng)還改善了膽汁酸代謝,從而減輕了Col引起的肝毒性。除了顯著的療效外,Eug-Col@Fucar還表現(xiàn)出優(yōu)異的生物安全性,適合長期應(yīng)用。總之,本研究開發(fā)了一種新型水凝膠遞送系統(tǒng),能夠增強藥物在GA治療中的療效,同時減輕Col長期臨床應(yīng)用所帶來的不良反應(yīng)。Eug-Col@Fucar為GA治療提供了一種有前景的策略,并具有廣泛的臨床應(yīng)用潛力。
論文第一作者為浙江大學(xué)博士生劉笑陽和浙江大學(xué)愛丁堡大學(xué)聯(lián)合學(xué)院博士后董佳,浙江大學(xué)周民教授為論文的通訊作者。上述研究得到了國家重點研發(fā)計劃項目、浙江省領(lǐng)軍創(chuàng)新創(chuàng)業(yè)團隊引進計劃等基金項目的大力支持。
全文鏈接:https://www.sciencedirect.com/science/article/pii/S2452199X25002154
版權(quán)與免責(zé)聲明:中國聚合物網(wǎng)原創(chuàng)文章。刊物或媒體如需轉(zhuǎn)載,請聯(lián)系郵箱:info@polymer.cn,并請注明出處。
(責(zé)任編輯:xu)
相關(guān)新聞
- 浙江大學(xué)周民團隊《Adv. Drug Deliver. Rev.》:光敏性微藻在靶向腫瘤治療中的應(yīng)用 2025-02-23
- 浙江大學(xué)周民團隊《Adv. Sci.》:新型微藻生物系統(tǒng)結(jié)合納米刀技術(shù)用于肝癌免疫治療 2025-02-10
- 浙江大學(xué)周民團隊《Nano Today》:微藻藥物遞送微球系統(tǒng)用于治療高尿酸血癥并伴有腎損傷 2025-01-06
- 蘇大劉莊/楊光保教授團隊招聘博士后 - 材料合成、納米醫(yī)學(xué)(腫瘤診療、藥物遞送、免疫治療等) 2025-04-29
- 四川大學(xué)楊佼佼/熊燕/李繼遙 Acta Biomater.: 用于減輕化膿性關(guān)節(jié)炎影像學(xué)和病理學(xué)損傷的原位雙靶向藥物遞送系統(tǒng) 2025-02-15
- 東華大學(xué)史向陽教授團隊 Nano Today:基于含磷樹狀大分子的藥物遞送系統(tǒng)協(xié)同增強自噬、抗炎和抗氧化治療阿爾茨海默癥 2025-02-11
- 西南醫(yī)大口腔醫(yī)院陶剛/黎春暉/蔡蕊團隊:具有ROS觸發(fā)藥物釋放特性的可注射水凝膠實現(xiàn)抗菌劑和抗炎納米顆粒協(xié)同遞送用于牙周炎治療 2025-04-15
