近日,國家納米科學中心王浩課題組李莉莉副研究員和喬圣林博士通過發展“活體自組裝”技術,在細胞內成功構建了不同拓撲結構的納米材料,并提出了全新的細胞內原位聚合和組裝策略,為功能性納米材料的設計提供了新思路。相關研究成果被Nature Communications雜志接收(DOI: 10.1038/s41467-017-01296-8);該工作已申請中國發明專利(申請專利號:201610408076.7)。
納米材料在生物醫學領域已被廣泛研究和認可,例如藥物遞送、組織工程等均得到了深入的研究。但是,納米材料獨特的生物界面效應,也使得其在復雜生命體中的遞送過程、物理化學轉化以及蓄積代謝等問題變得十分棘手。因此,王浩課題組提出了“活體自組裝”理念,獨特設計納米材料的建筑單元,將外源引入的分子參與到生命體的功能性組裝過程中,實現了在生理環境下自發的納米材料構建和功能化。這一獨特思路,為生物醫用納米材料領域的設計和應用提供了新視角和新途徑。
在納米材料的生物功能應用中,拓撲結構對活體器官、組織和細胞的功能影響顯得尤為重要。前期報道指出特定拓撲結構在生命體中扮演者獨特的角色,例如雙螺旋結構的DNA,具有特定3D結構的蛋白大分子,以及各種傳導信號的分子復合體等等。當然,材料和界面的拓撲結構也同樣影響著生物功能,例如,界面的形態會誘導干細胞定向分化、決定細胞遷移和內吞等功能。因此,深入研究在特定區域內材料拓撲結構與生物功能之間的關系,將為精準功能化納米材料的設計提供指導。然而,目前體外構筑的納米材料,不能區分界面和胞內作用,干擾了限域拓撲結構和生物功能關系的分析和理解。
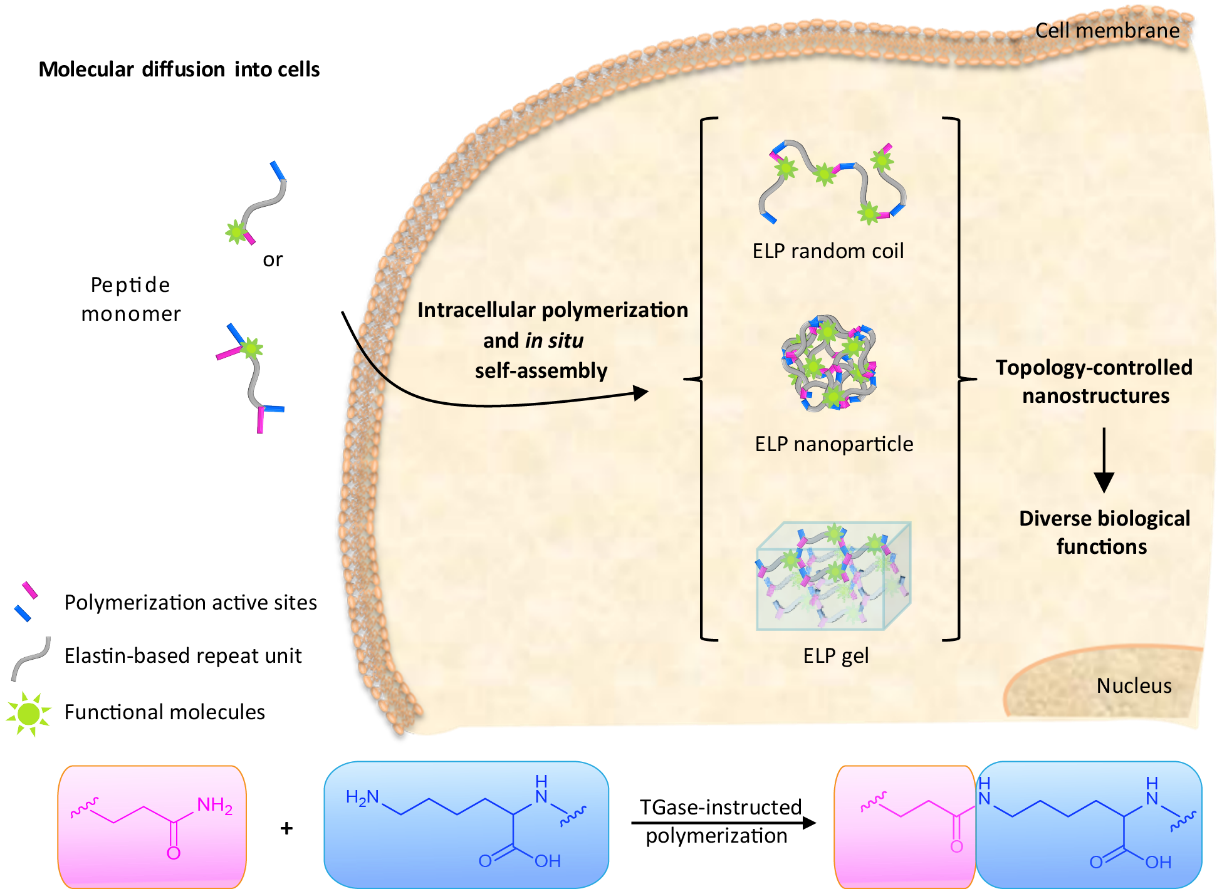
針對特定區域內材料與功能之間的關系研究,王浩課題組發展了細胞內原位聚合和組裝的新方法,首次實現了在細胞內平行構筑不同拓撲結構的納米材料,為研究胞漿拓撲結構和功能的關系提供了有效手段。通過設計不同氨基酸序列的多肽聚合單體,實現了在胞內聚合過程中,對聚合物分子量大小、溫敏性質以及組裝后的拓撲結構的調控;同時,在細胞和組織水平原位的證實了多肽單體的聚合和組裝過程;最后,綜合評價了不同拓撲結構的納米組裝體的滯留效應和細胞毒性等生物功能,為精準設計功能化納米材料提供基礎參考。
該研究得到了國家自然科學基金、創新群體項目、中科院國際合作、交叉團隊、青促會等項目的支持。
