澳門大學王瑞兵團隊 JACS: 乏氧誘導的超分子自由基實現胞內聚合介導的腫瘤精準治療
2025-01-15 來源:高分子科技
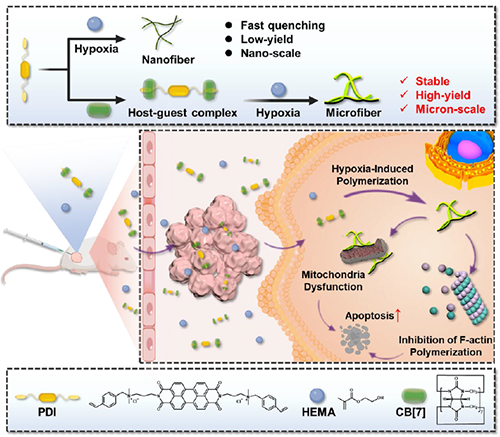
圖1:腫瘤乏氧微環境中超分子自由基陰離子誘導的胞內聚合示意圖。
近期,澳門大學王瑞兵團隊提出了一種乏氧引發的超分子自由基體系,能夠誘導胞內聚合反應,從而破壞腫瘤細胞的細胞骨架和細胞器的生理功能(圖1)。該工作利用葫蘆[7]脲(CB[7])和苝二酰亞胺衍生物(PDI)形成2:1超分子主客體復合物,稱為PDI+2CB[7],該復合物可響應腫瘤乏氧和還原微環境,產生離域自由基陰離子。同時,CB[7]有效地增強了這些陰離子的結構穩定性,使PDI+2CB[7]復合物能夠在腫瘤細胞內誘導甲基丙烯酸2-羥乙酯(HEMA)發生高效自由基聚合反應(圖2)。該體系可選擇性地在乏氧腫瘤細胞中發生聚合反應,引起嚴重的細胞毒性(圖3),誘導ROS過表達和線粒體功能障礙,從而導致細胞凋亡和細胞周期阻滯(圖4),改變肌動蛋白的有序分布,導致細胞骨架損傷(圖5)。動物實驗結果證明乏氧引發的細胞內聚合具有高效抗腫瘤作用(圖6&圖7)。 這項研究開發了一種胞內聚合誘導的抗腫瘤療法,而非傳統化療藥物治療方式,具有高選擇性和強效抗腫瘤作用。該工作以“Hypoxia-Initiated Supramolecular Free Radicals Induce Intracellular Polymerization for Precision Tumor Therapy”為題發表在《J Am Chem Soc》上(doi:org/10.1021/jacs.4c14847)。文章第一作者是澳門大學博士生唐冕同學,共同通訊作者是課題組前成員高成博士(現任職于深圳大學醫學院)。合作者包括清華大學的徐江飛教授和法國科學院的Bardelang教授。該研究得到國家自然科學基金委、澳門科技發展基金、澳門大學、以及太湖創新計劃的支持。
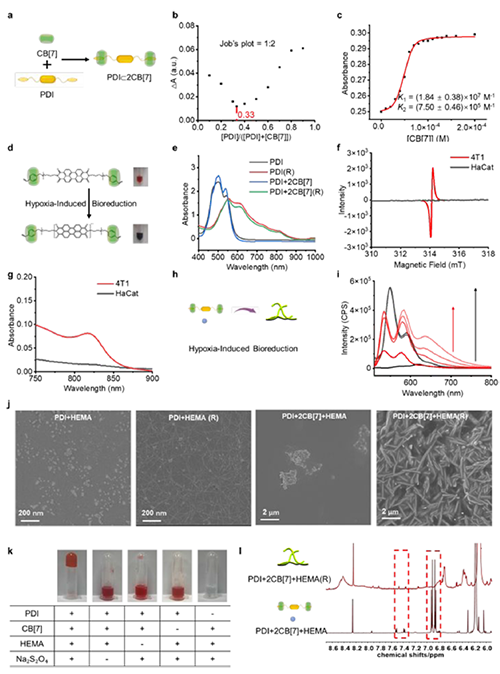
圖2: PDI+2CB[7]主客體復合物的形成和超分子自由基引發的聚合反應。
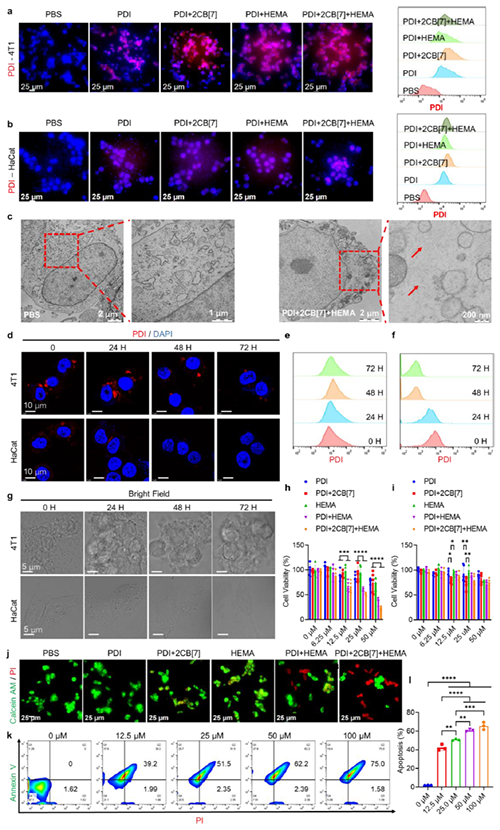
圖3: 腫瘤細胞內聚合反應引發細胞毒性。
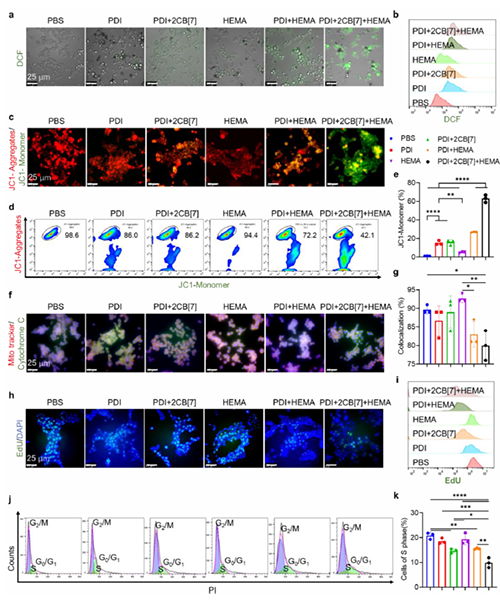
圖4: 腫瘤細胞內聚合反應對細胞功能的影響。
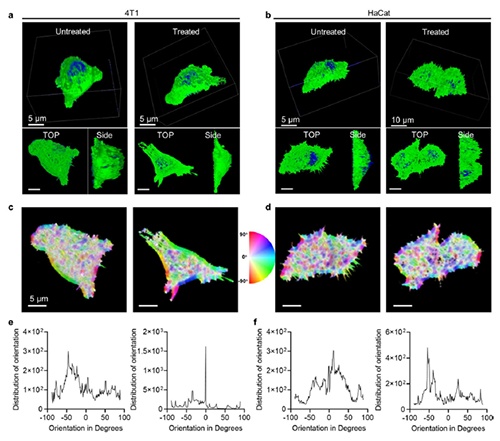
圖5: 腫瘤細胞內聚合反應對肌動蛋白細胞骨架的影響。
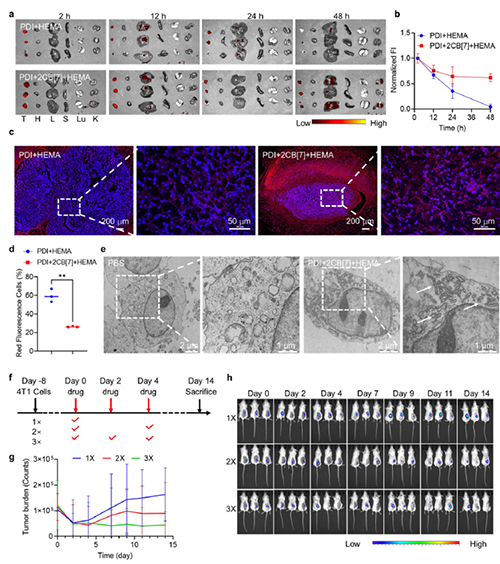
圖6: 活體腫瘤細胞內選擇性胞內聚合反應。

圖7:活體胞內聚合反應對腫瘤的治療作用。
原文鏈接:https://doi.org/10.1021/jacs.4c14847
版權與免責聲明:本網頁的內容由中國聚合物網收集互聯網上發布的信息整理獲得。目的在于傳遞信息及分享,并不意味著贊同其觀點或證實其真實性,也不構成其他建議。僅提供交流平臺,不為其版權負責。如涉及侵權,請聯系我們及時修改或刪除。郵箱:info@polymer.cn。未經本網同意不得全文轉載、摘編或利用其它方式使用上述作品。
(責任編輯:xu)
相關新聞
- 華東師范大學化學與分子工程學院超分子化學團隊博士后招聘啟事 2021-09-14
- 清華大學張希教授課題組發現基于超分子自由基的選擇性抗菌光熱新材料 2017-12-21
- 華南理工朱偉、南科大余沛源、南洋理工趙彥利 Nat. Commun.:納米隔室限域效應介導生物體內聚合反應 2023-08-30
- 國家納米科學中心王浩研究員課題組:“活體自組裝”生物納米材料研究獲進展 2017-11-09
- 常州大學王建浩教授團隊《Acta Biomater.》:藥物儲庫型聚合物納米膠束用于腫瘤長效治療的研究成果 2025-07-08
- 中山大學吳丁財/黃榕康/鄭冰娜/王輝團隊 Adv. Mater.:具有長駐留性的可注射多孔炭納米酶水凝膠實現腫瘤的協同治療 2025-07-04
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
