炎癥與包括腫瘤在內的眾多疾病的發生發展息息相關。迅猛發展的納米技術為炎癥相關疾病的診斷和治療提供了新的思路、方法和工具。其中,基于納米探針的光學成像因其獨特的靈敏性和非侵襲性受到越來越多研究者的青睞。而傳統的光學成像納米探針由于受到外界激發光穿透能力以及生物降解等因素的影響,其在基礎研究領域和臨床兩方面的應用依然面臨諸多挑戰。
基于炎癥局部活性氧(ROS)異常升高以及中性粒細胞浸潤的特征,張建祥教授團隊構建了集自發光成像與光動力治療于一體的髓過氧化物酶(MPO)/ROS響應性納米粒。具體思路為,將發光基團Luminol和親水性聚乙二醇(PEG)共價鍵合于光敏劑Ce6,形成兩親性共聚物CLP,通過其自組裝得到具有核-殼結構的納米粒。在激活中性粒細胞分泌的MPO催化下,炎癥局部富含的過氧化氫可生成具有超強氧化能力的次氯酸根,氧化Luminol發光,并可通過共振能量轉移(BRET)激發Ce6產生近紅外光。由于近紅外光的組織穿透能力強于Luminol本身的自發光,適宜于深層組織成像,可有效運用于腹膜炎、急性肺損傷和結腸炎的成像診斷中。CLP納米粒的自發光強度與結腸炎相關指標呈正相關,可用于炎癥疾病發展進程的示蹤研究。另一方面,激活的光敏劑Ce6還伴隨有單線態氧的產生,可用于無需外界激發的原位光動力腫瘤治療。可以預見,這種基于ROS響應性的自發光納米系統可以為炎癥性疾病的診斷和治療提供強有力的工具。
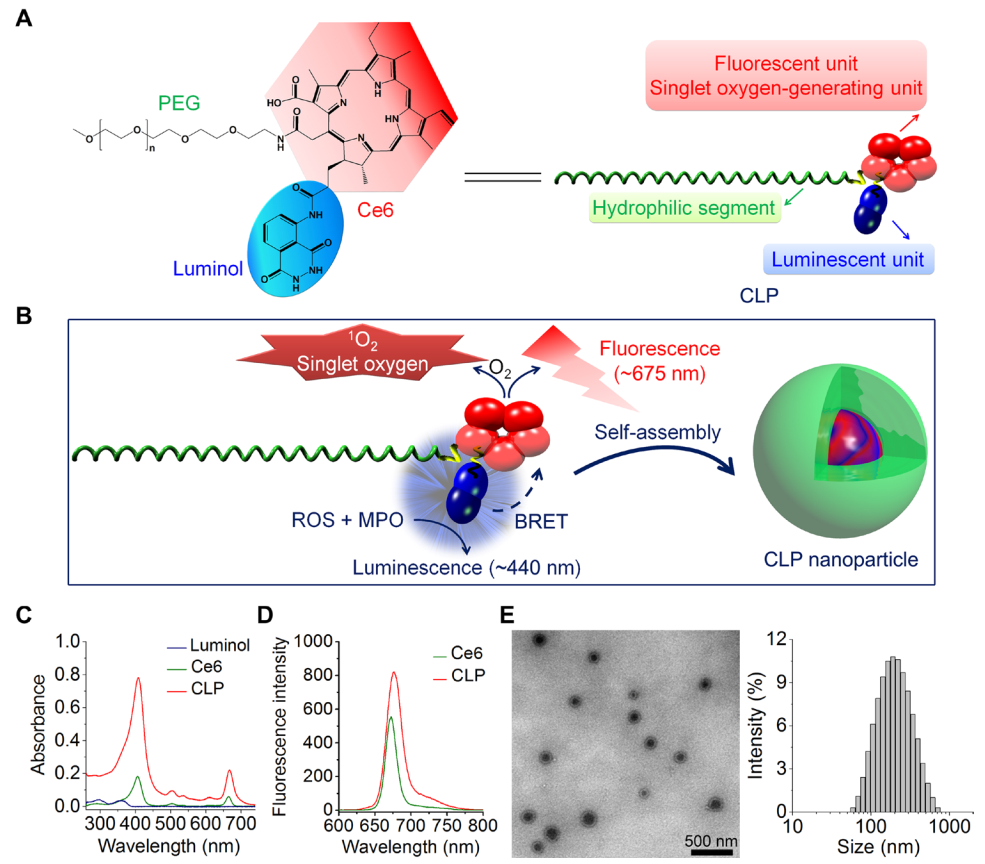
圖1. 自發光納米粒的構造示意圖及表征。(A)兩親性共聚物CLP的設計示意圖;(B)兩親性共聚物CLP自組裝成納米粒的示意圖;(C)紫外吸收圖譜;(D)熒光圖譜;(E)CLP納米粒的透射電鏡圖及粒徑分布圖。
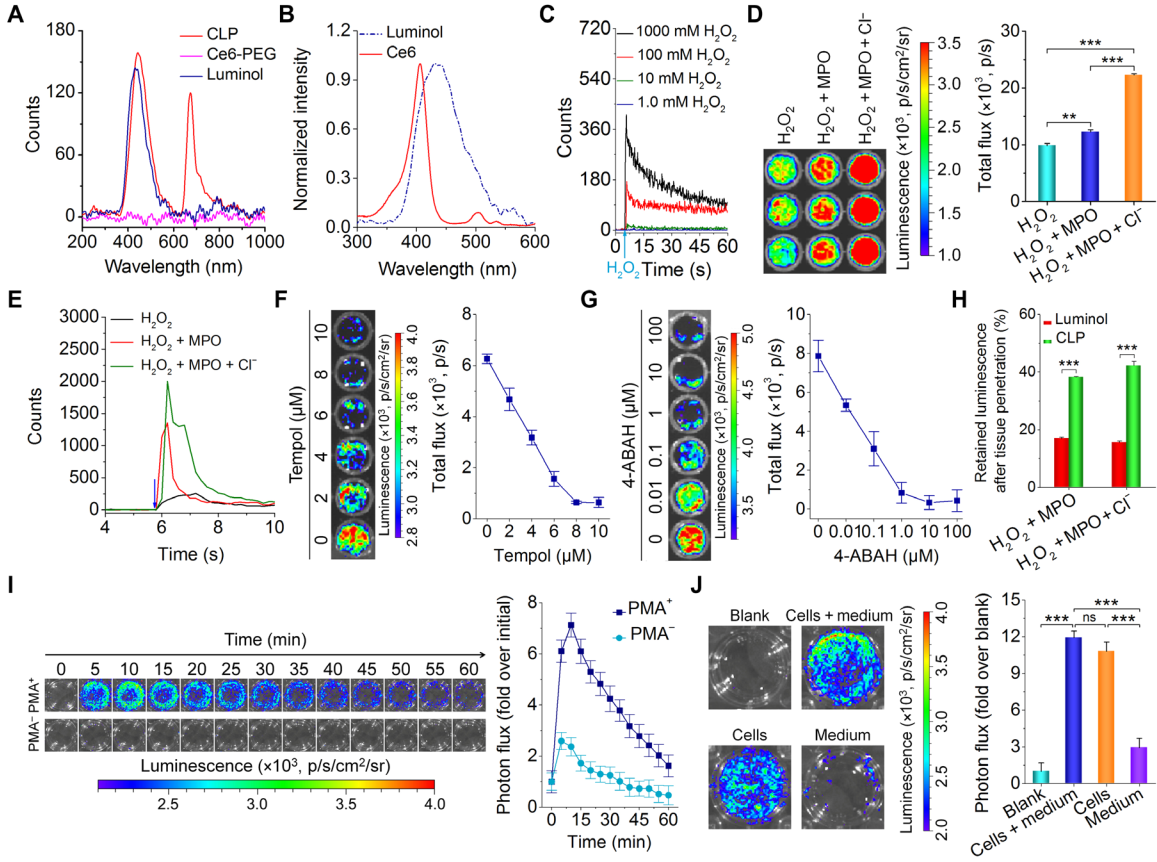
圖2. 體外BRET效果驗證及CLP納米粒的自發光性能研究。(A)CLP,Ce6-PEG及Luminol的自發光圖譜;(B)Luminol的自發光圖譜和Ce6吸收圖譜的重合情況;(C)雙氧水濃度對CLP納米粒自發光強度及發光持續時間的影響;(D,E)不同氧化條件對CLP納米粒自發光強度的影響;(F,G)ROS清除劑Tempol及MPO抑制劑4-ABAH對CLP納米粒自發光強度的抑制效果;(H)體外對比Luminol和CLP納米粒的自發光穿透能力;(I)CLP納米粒對活化及非活化中性粒細胞自發光成像活能力對比;(J)CLP納米粒對活化中性粒細胞成像部位的考察。

圖3. CLP納米粒對小鼠炎癥模型的體內自發光成像研究。(A)腹腔注射不同藥物后,腹膜炎模型鼠自發光成像研究;(B)靜脈注射不同藥物后,腹膜炎模型鼠自發光成像研究;(C)靜脈注射不同藥物后,急性肝損傷模型鼠的自發光成像研究;(D)直腸灌注不同藥物后,結腸炎模型鼠自發光成像研究;(E)離體結直腸體外自發光成像研究;(F)luminol及CLP納米粒給藥后,結腸炎模型鼠自發光成像持續時間研究.

圖4. CLP納米粒對結腸炎不同發展進程的體內自發光成像研究。(A,B)CLP納米粒對不同發展程度結腸炎自發光成像及統計結果;(C-E)不同發展進程結腸炎小鼠的疾病指數,MPO水平及H2O2水平定量研究;(F,G)不同發展進程的結腸炎小鼠腸道組織中性粒細胞數目的流式分析及統計結果;(H)自發光成像結果與疾病相關指標的相關性研究;(I,J)不同發展進程的結腸炎小鼠的直腸組織H&E切片及組織學活性指數評分。
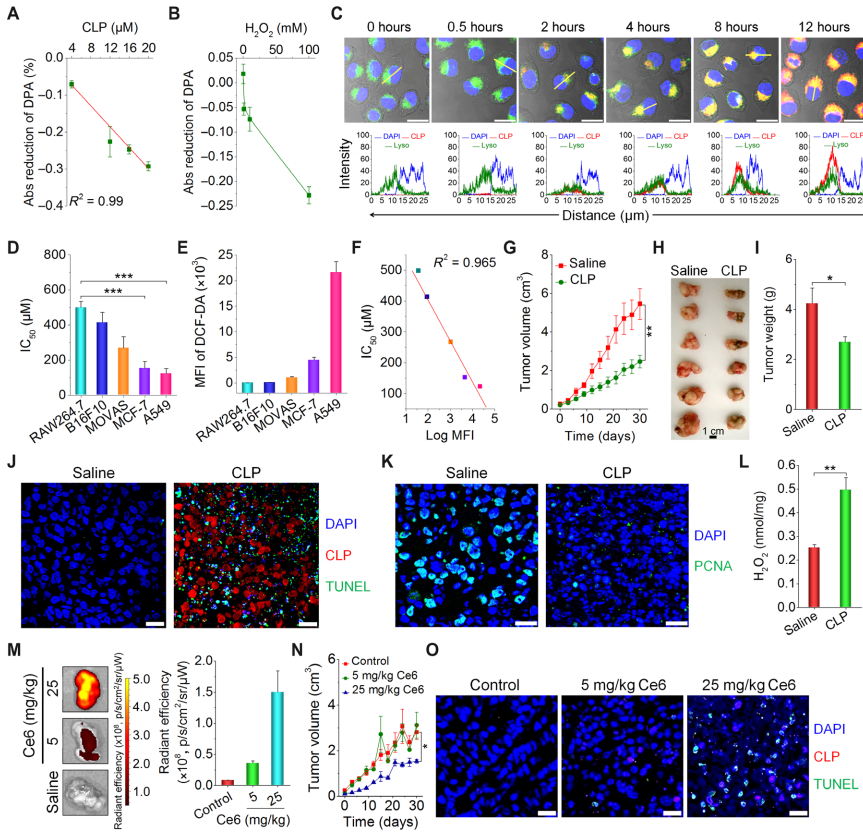
圖5. CLP納米粒體內外抗腫瘤活性研究。(A,B)CLP納米粒劑量及H2O2濃度對單線態氧產量的影響;(C)A549細胞對CLP納米粒內吞的時間依賴性;(D)不同細胞與CLP納米粒共孵育24h后的IC50;(E)不同細胞與CLP納米粒共孵育后胞內ROS變化;(F)IC50與ROS水平之間的相關性分析;(G-I)通過瘤內給藥方式治療時的腫瘤生長曲線及治療第30天時的腫瘤照片,腫瘤重量的統計結果;(J,K)通過瘤內給藥方式治療30天后,腫瘤切片的TUNEL及PCNA染色;(L)瘤內給藥方式治療30天后腫瘤組織的ROS變化;(M)A549移植瘤小鼠尾靜脈注射CLP納米粒7天后,腫瘤離體熒光成像照片及統計結果;(N)通過尾靜脈給藥方式治療時的腫瘤生長曲線;(O)通過尾靜脈給藥方式治療30天后腫瘤切片的TUNEL染色。
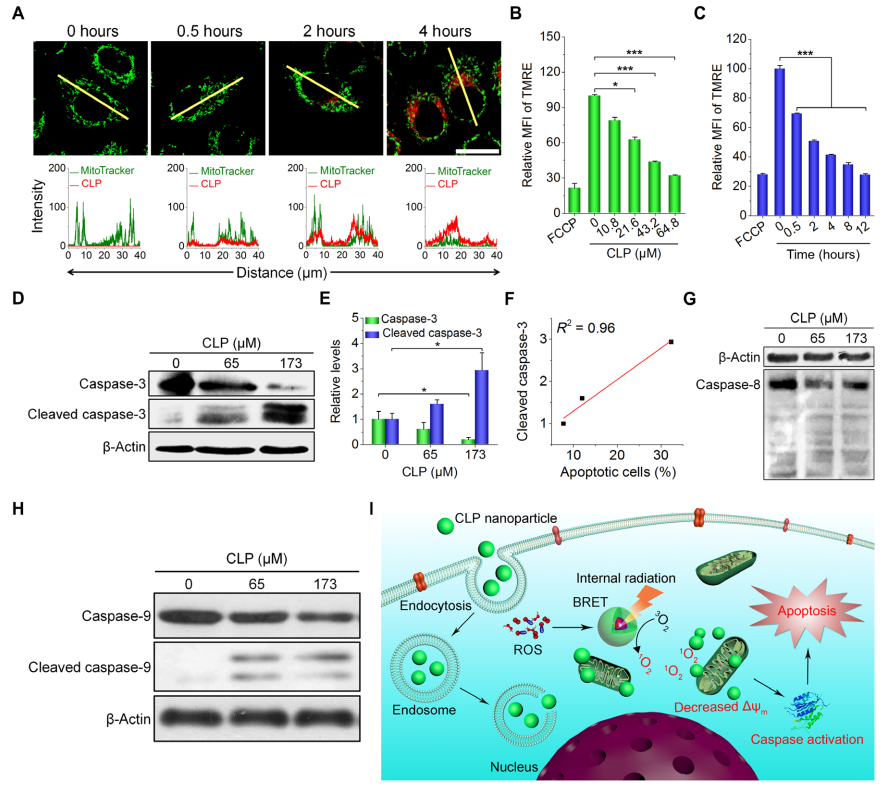
圖6. CLP納米粒在A549細胞水平上的抗腫瘤機制研究。(A)CLP納米粒和A549細胞線粒體共定位研究;(B,C)CLP納米粒劑量與孵育時間對線粒體膜電位的影響;(D,E)A549細胞與CLP納米粒孵育24h后,caspase-3及cleaved caspase-3含量的WB檢測圖及定量結果;(F)凋亡細胞百分數與cleaved caspase-3表達水平的相關性分析;(G,H)A549細胞與CLP納米粒孵育24 h后,caspase-8以及caspase-9含量的WB檢測圖。(I)CLP納米粒的抗腫瘤機制示意圖。
該工作以A self-illuminating nanoparticle for inflammation imaging and cancer therapy為題發表在綜合性刊物Science Advances上。論文的第一作者為博士生徐曉秋和安會杰,通訊作者為張建祥教授。
張建祥教授課題組長期從事炎癥相關疾病的成像與靶向治療研究,近兩年的成果還先后發表于Journal of the American College of Cardiology, 2018, 72(21): 2591-2605; Advanced Science, 2018, 5(10): 1800781; ACS Nano, 2018, 12(9): 8943-8960; Materials Today, 2017, 20(9): 493-500;Biomaterials, 2017, 143: 93-108;Materials Today, 2017, 20(6): 301-313; Nano Letters, 2017, 17(2): 1056-1064.
- 暨南大學寧印教授 Angew:單晶顆粒內部微觀結構的空間調控 2025-05-05
- 東華大學劉庚鑫團隊 Macromolecules:軟納米粒子熔體流變揭示解纏結的原理和極限 2025-04-17
- 浙江大學周民團隊《Adv. Sci.》:吸入式納米粒子誘導細菌銅死亡用于感染性肺炎治療 2025-02-27
- 天津大學宋東坡教授課題組 Angew:超分子瓶刷自組裝構筑納米到微米跨尺度光學結構 2025-05-15
- 東北林業大學劉守新教授團隊 Small:乙醇介導的膠束自組裝實現具有單晶形態和可調孔結構的有序介孔炭 2025-05-02
- 復旦大學王國偉團隊 Macromolecules:突破自組裝技術新邊界 - 高固含量下嵌段共聚物的熱誘導自組裝與熱誘導協同自組裝 2025-04-27
- 東華大學郭睿教授/史向陽教授課題組《ACS AMI》:樹枝大分子包裹銅鉑雙金屬納米酶用于腫瘤微環境調控光熱/催化療法 2025-06-19
