隨著納米生物技術和納米醫藥的發展,生物活性分子體內原位構筑超分子組裝體的概念越來越受人們的重視。實現對聚合物的可控組裝調控,對改進材料在體內的生物效應和安全性,具有重大意義。但是,由于生物醫用材料在體內的生物過程極其復雜,如何實現聚合物在病生理條件下的組裝調控,是醫用高分子領域極具挑戰性的科學問題。而對這些化學材料基礎問題的深入研究,對于闡明聚合物材料在體內的吸收、分布、轉運和代謝過程至關重要。中國科學院國家納米科學中心王浩研究員課題組一直致力于發展體內原位自組裝的新型生物納米材料,對其在生命體的組裝過程和機制進行了系統研究,并探索了其在腫瘤成像和治療方面的應用(Adv. Mater. 2015, 27, 6125;Nat. Commun. 2017, 8, 1276;Adv. Mater. 2018, 1804971;Adv. Mater. 2019, 1807175)。
如何實現納米藥物在腫瘤部位的深層滲透及有效富集,是目前腫瘤治療中亟待解決的關鍵科學問題之一。王浩研究員和喬增瑩研究員發展了溫度敏感型的多肽聚合物,其在血液循環中為單分子狀態,由于較小的尺寸可以深層滲透到腫瘤內部;利用溫敏聚合物與光熱分子的結合,在近紅外照射下實現了多肽聚合物在腫瘤部位的原位自組裝,有效提升了納米藥物在腫瘤部位的滲透深度及富集效率(Nano Lett. 2018, 18, 6577-6584)。由于腫瘤微環境呈微酸性,進一步設計合成了弱酸條件下可發生自組裝的多肽聚合物,利用腫瘤微環境pH來調控其在體內的自組裝行為。pH響應型的多肽聚合物能夠以單鏈的形式滲透到實體腫瘤的深層部位,并且在腫瘤微環境弱酸的刺激下發生聚集,恢復材料較高的入胞能力,從而實現對實體腫瘤內部細胞的高效殺傷(Angew. Chem. Int. Ed. 2019, 58, 4632-4637)。
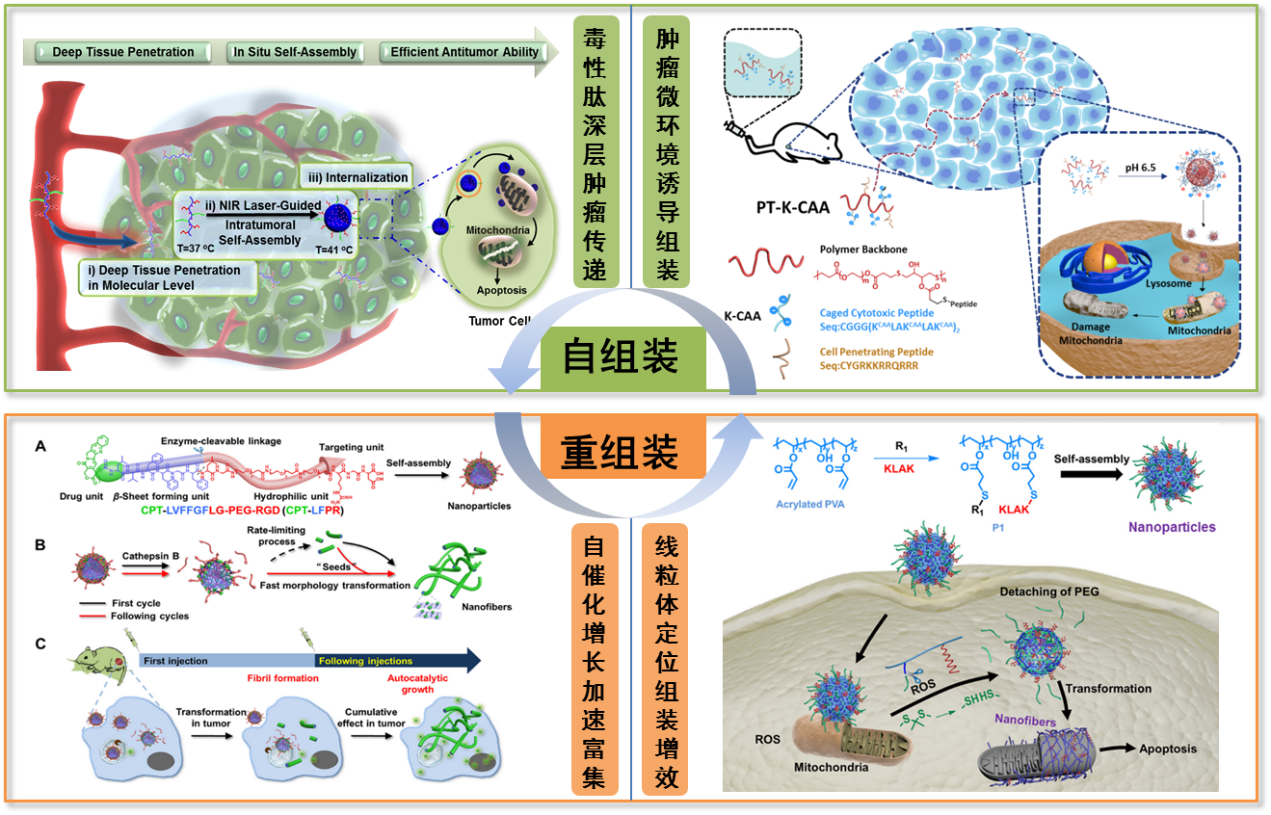
生物體內的組裝行為是一個非常復雜的過程,人們面臨的一項巨大挑戰是如何通過設計分子單元精準調控其體內的組裝進程,從而提升藥用功能。王浩研究員、喬增瑩研究員和程冬炳博士利用體內重組裝的調控策略,實現了納米藥物在腫瘤部位的有效富集。連接抗癌藥物的納米粒子在腫瘤部位重組裝形成初級納米纖維,其可起到“晶種”的作用,進一步促進納米粒子的形態轉變,使納米纖維的增長速度明顯加快,從而實現抗癌藥物在腫瘤部位的加速積累,為提升藥物在腫瘤部位的富集提供了新策略(J. Am. Chem. Soc. 2019, 141, 4406-4411)。在重組裝調控的基礎上,進一步發展了ROS刺激響應型的多肽聚合物,其在線粒體可以定位組裝形成納米纖維。在形態轉變的過程中,治療性肽可以通過多位點與線粒體膜發生相互作用,極大地增強了對線粒體膜的破壞作用,從而有效提升腫瘤治療效果(J. Am. Chem. Soc. 2019, DOI: 10.1021/jacs.1028b07727, 封面文章)。該系列特色工作受收到廣泛關注,并受邀撰寫綜述(Acc. Chem. Res. 2019, 52, 367-378)。
該系列研究得到了國家自然科學基金委和中科院國際合作、交叉團隊等項目的支持。
論文鏈接:
https://pubs.acs.org/doi/10.1021/jacs.8b07727
https://pubs.acs.org/doi/10.1021/acs.accounts.8b00398
- 華東理工劉潤輝教授課題組《ACS Cent. Sci.》:新型陽離子催化策略實現N-羧基環內酸酐(NCA)的快速可控聚合 2024-10-30
- 華東理工劉潤輝教授課題組 Nat. Protoc.:NCA敞口快速開環聚合制備多肽聚合物的方法 2024-10-10
- 華東理工劉潤輝教授課題組 JACS:化療藥物與膜裂解抗腫瘤β-多肽聚合物的協同組合可逆轉腫瘤耐藥性 2024-04-12
- 浙大王征科課題組《Adv. Sci.》綜述:生物材料在角膜再生中的應用 2025-01-02
- 浙江大學周泉/劉祥瑞/周天華等 Adv. Mater.:開發出能預防多種腫瘤術后并發癥的新型生物醫用材料 2024-04-23
- 同濟大學杜建忠/南方醫科大學口腔醫院賈搏團隊 Chem. Soc. Rev. 綜述:口腔醫用高分子材料 2024-03-26
