癌癥是嚴重危害人類健康的重大疾病之一,化療藥物在癌癥治療中發揮著重要作用。然而,這些小分子化療藥物具有嚴重的毒副作用,主要源于其無差別的體內分布及腫瘤細胞多藥耐藥性的發生發展。如鉑類抗腫瘤藥物(順鉑、奧沙利鉑等),在臨床上長期廣泛應用的過程中,逐漸產生嚴重的耐藥性問題,包括細胞攝取降低,外排增加,胞內GSH解毒以及增強受損DNA的修復等。為了解決該問題,設計發展了多種鉑類納米藥物(如大分子類鉑復合物,脂質體,膠束,介孔硅,二維材料),增強腫瘤細胞攝取,抑制GSH解毒功能,在一定程度上可抑制鉑耐藥性發展。然而由于鉑的外排通路未受到抑制,這些鉑類納米藥物并未徹底逆轉腫瘤耐藥,其抗腫瘤效果仍有很大地提高空間。鈀與鉑具有相似的外層電子結構和配位化學性質,表現出治療鉑耐受腫瘤的潛在效力。然而鈀類配合物體內水解迅速、靜脈注射的無差別遞送、高親水性導致腫瘤部位滯留能力差。這些都嚴重限制了鈀類化合物在腫瘤治療,特別是對于鉑耐藥腫瘤治療的應用。
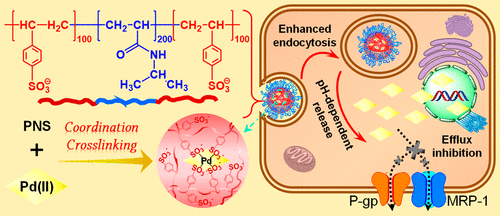
為了解決該問題,楊祥良教授和趙彥兵教授的課題組通過原子轉移自由基聚合設計了一種三嵌段溫敏聚合物(聚苯乙烯磺酸鈉-聚N-異丙基丙烯酰胺-聚苯乙烯磺酸鈉),并與四氯鈀酸鉀(K2PdCl4)自組裝形成鈀離子(Pd(II))配位交聯的溫敏納米凝膠(Pd-PNS)。Pd-PNS具有高達40%的Pd(II)負載量,且實現了腫瘤酸性微環境調控的Pd(II)緩控釋藥特征。而且,Pd-PNS具有優異的溫敏溶膠-凝膠相轉變行為,可用于局部瘤內注射給藥。通過在腫瘤局部的原位凝膠化,實現了高度親水Pd(II)在腫瘤部位的長效滯留。組織分布實驗表明注射14天后,與游離組僅存11.1%相比, Pd-PNS納米凝膠組仍有高達49.7%的Pd(II)滯留在小鼠腫瘤內。因此,Pd-PNS納米凝膠可有效發揮Pd(II)增強攝取、抑制胞內外排等逆轉鉑耐藥能力。DNA斷裂損傷,腫瘤干細胞殺傷以及荷瘤裸鼠抑瘤等實驗都證實了與游離Pd(II)和相應的載順鉑PNS納米凝膠相比,Pd-PNS納米凝膠對于鉑耐受腫瘤具有更為優異的治療效果。
該工作為治療順鉑耐受腫瘤提供了一種新思路,為Pd(II)化合物瘤內長效滯留提供了一種新策略。
以上成果發表在Chemistry of Materials (Chem. Mater. 2019, DOI: 10.1021/acs.chemmater. 9b00986)上。華中科技大學生命科學與技術學院在讀博士生趙浩與2014級本科生畢業生徐家寶為該論文的共同第一作者。生命科學與技術學院黃文晶博士參與了該項研究。該研究得到國家重點研究計劃(2018YFA0208903)和國家自然科學基金(81673016, 81773653)的資助。
- 浙理工鐘齊教授團隊《Adv. Opt. Mater.》:受唐代裝飾紋樣啟發的復合納米凝膠基可涂繪型紋身貼用于紫外線輻照監測 2023-01-07
- 北化尹梅貞教授團隊《Nano Today》:雙重增敏的苝酰亞胺基納米光診療劑用于腫瘤溫和光治療 2022-03-22
- 華南理工大學賈永光《Chem. Eng. J.》綜述:具有最高臨界溶液溫度的聚合物藥物載體及其應用 2022-01-10
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 東華大學史向陽教授團隊:外泌體包裹的響應性樹狀大分子納米凝膠可實現急性肺損傷的免疫調節和抗氧化聯合治療 2025-05-15
- 東華大學史向陽/沈明武團隊 Acta Biomater.:仿生含銅納米凝膠用于磁共振成像引導的腫瘤化療-化學動力學治療-免疫治療 2024-10-03
