糖尿病是一種以高血糖為特征的慢性代謝疾病,目前治療方法主要是皮下注射胰島素和口服降糖藥,但存在頻繁注射、胰島素抵抗、低血糖、血糖失控等問題,給患者帶來諸多不便,因此亟需不打胰島素、不吃降糖藥糖尿病新療法。
2017年,杜建忠教授課題組提出了“以糖控糖”新概念。該課題組設計了一種基于糖聚合物及糖結合蛋白的可“呼吸”糖的囊泡(也稱為納米“糖海綿”),它能在血糖濃度升高時自動“吸入”葡萄糖并存儲起來,而在血糖濃度降低時自動“呼出”葡萄糖,從而維持血糖穩定,即“以糖控糖”(J. Am. Chem. Soc. 2017, 139, 7640-7647; C & EN 2017, 95, 9)。
最近,他們又構建了第二代“以糖控糖”囊泡(如圖1)。該囊泡是通過苯硼酸糖聚合物PEO-b-P(CMA-stat-AAPBA-stat-AGA)自組裝形成的。其中,苯硼酸嵌段AAPBA與葡萄糖及含糖嵌段AGA的動態結合作用賦予了囊泡的吸糖、釋糖特性;含糖嵌段AGA還可以增強囊泡的生物相容性;光交聯嵌段CMA可延長囊泡的體內循環時間。該囊泡像人工肝臟一樣,可實現葡萄糖的動態置換:當外界葡萄糖濃度升高時,囊泡吸入葡萄糖,并將其存儲在囊泡中(表現為溶脹);當外界葡萄糖濃度降低時,囊泡釋放葡萄糖(表現為收縮)。
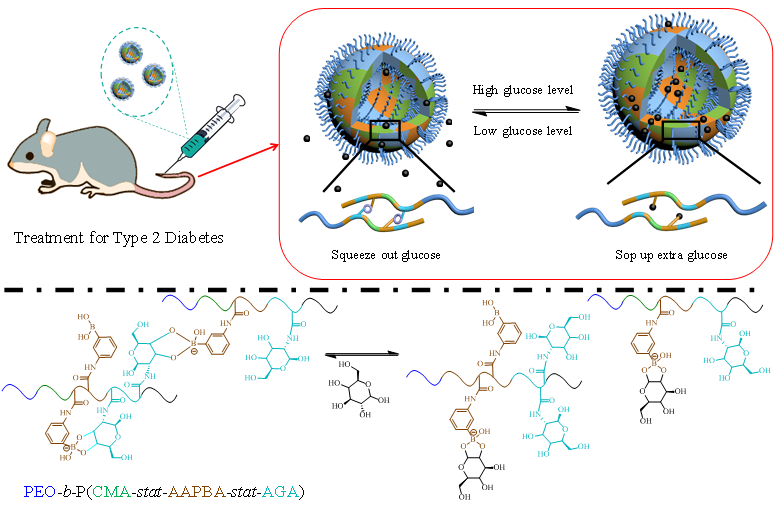
圖1. 第二代“以糖控糖”囊泡的設計思想及其血糖調控性能
體外實驗表明,該囊泡調控葡萄糖過程中伴隨著明顯的粒徑變化,其攝取和釋放葡萄糖的臨界濃度約為100 mg / dL,這與正常人血糖水平(70~110 mg / dL)相符合(圖2)。
體內實驗表明,該囊泡對2型糖尿病小鼠具有良好的長效血糖調控作用,注射一次可維持正常血糖水平30 h,并在70 h內仍有療效,且具備較低的生物毒性(圖3)。
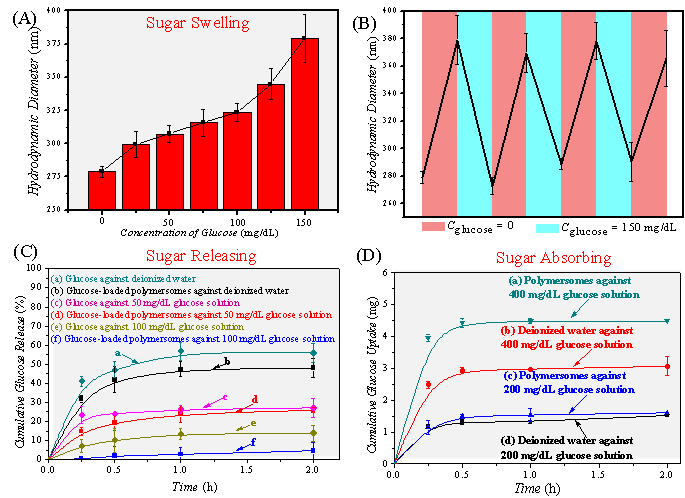
圖2. “以糖控糖”囊泡的血糖調控行為
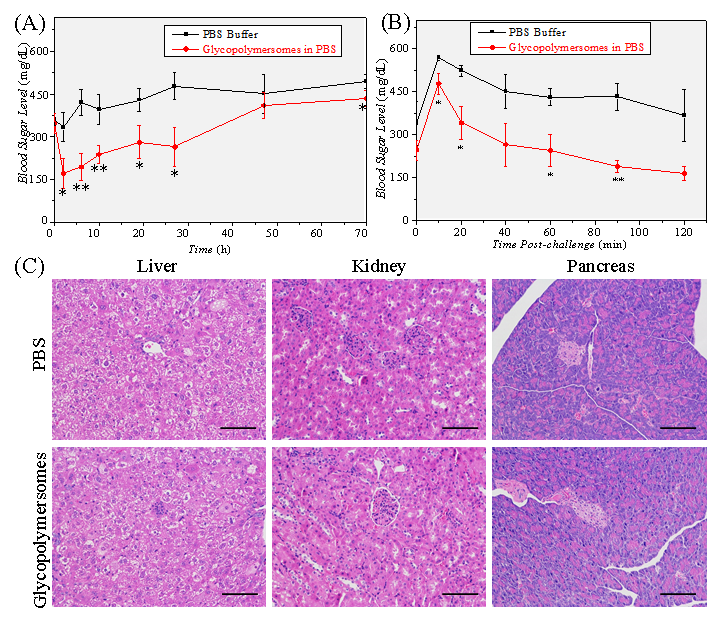
圖3. “以糖控糖”囊泡的體內降糖實驗及組織切片分析結果
與第一代“以糖控糖”囊泡相比,第二代囊泡不需要糖結合蛋白的輔助,生物相容性得到提升,制備過程也大為簡化。
這一成果以“Controlling blood sugar levels with a glycopolymersome(以糖控糖)”為題發表在英國皇家化學會權威期刊《Materials Horizons》(Mater. Horiz. 2019, DOI: 10.1039/C9MH00625G; IF 14.356)上。同濟大學博士生蕭雨芬和碩士生胡宇是論文的共同第一作者,杜建忠教授為通訊作者。
論文鏈接:https://pubs.rsc.org/en/content/articlelanding/2019/MH/C9MH00625G#!divAbstract
杜建忠教授課題組主頁:https://jzdu.tongji.edu.cn/
- 川大華西口腔醫學院甘雪琦教授課題組 CEJ: 具有調控免疫反應及促線粒體轉移的新型水凝膠促進糖尿病慢性傷口愈合 2025-05-21
- 福州大學林子俺研究員團隊 AFM:一種具有自氧化特性的鄰位二羥基廣譜抗菌共價有機框架水凝膠用于促進糖尿病傷口愈合 2025-05-06
- 南開大學劉定斌教授團隊 JACS:智能水凝膠精準遞送外泌體 - 攻克糖尿病耐藥菌感染創面愈合難題 2025-05-06
- 河南大學《Adv. Sci.》:高分子囊泡彈性對腦腫瘤靶向影響研究新進展 2021-09-02
- 同濟大學杜建忠教授提出 “酸誘導吸附”和“親和強化吸引”原理以高效包載生物大分子 2020-05-15
- 同濟大學杜建忠教授課題組提出氨基酸環內酸酐開環聚合誘導自組裝(NCA-PISA)新方法 2019-09-17
