盡管ROS響應性智能藥物遞送系統近年來發展迅速,但由于腫瘤細胞內ROS的濃度相對較低(雖然比正常組織細胞內ROS濃度高),往往不足以快速有效地刺激藥物遞送系統釋放活性藥物。因此腫瘤細胞內較低的ROS濃度已成為ROS響應智能給藥系統進一步發展的瓶頸。
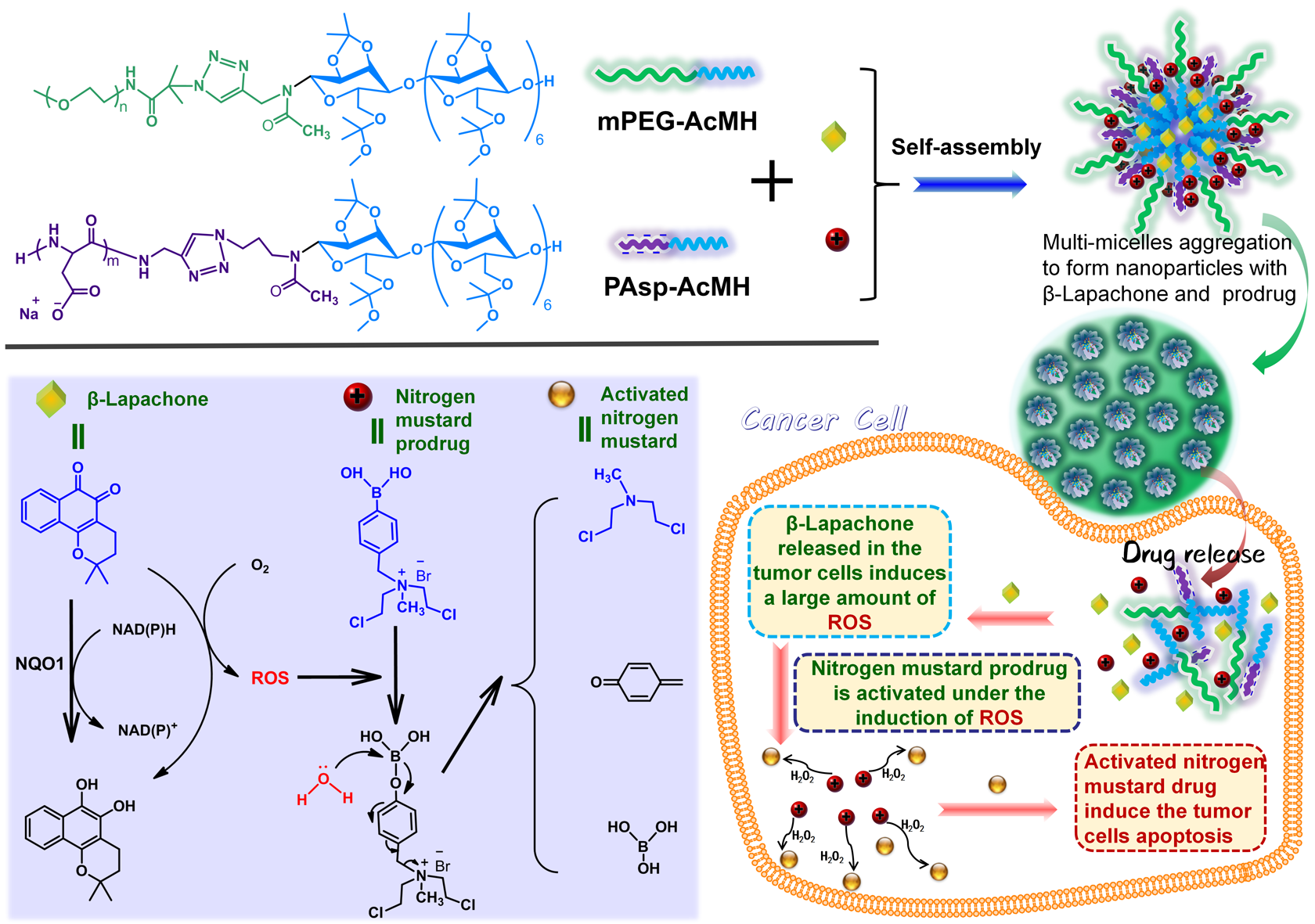
圖1 負載β-拉帕醌和氮芥前藥納米粒子的制備及其在腫瘤細胞內前藥的順次誘導激活
該工作旨在選擇性地增加腫瘤細胞中的H2O2水平,從而為ROS響應性藥物控釋系統提供藥物釋放條件。如圖1所示,蘭州大學趙光輝副教授課題組與蘭州大學基礎醫學院程菊老師合作,研發了一種新型的ROS響應藥物釋放平臺,它可以有效地同時遞送ROS響應性氮芥前藥和產生ROS的β-拉帕醌。首先設計并合成了兩個兩嵌段分子(mPEG-AcMH和PAsp-AcMH),用以構建“順次誘導激活”釋藥體系。選擇生物相容好且富含官能團的天然化合物麥芽七糖作為骨架分子,麥芽七糖分子通過縮醛化反應使其形成作為疏水鏈段的AcMH;PAsp是聚氨基酸鏈段,其具有帶負電荷的側鏈以靜電吸附氮芥前藥作為親水鏈段。上述兩個分子通過Click反應連接形成兩親性嵌段聚合物PAsp-AcMH。為了使藥物載體有更好的生物相容性,制備了另一種兩嵌段分子mPEG-AcMH。最后兩種兩嵌段分子、帶正電荷的氮芥前藥和β-拉帕醌自組裝形成初級膠束,其進一步聚集形成藥物共遞送的納米顆粒。靜脈注射使其進入動物血液循環系統后,納米顆粒通過EPR效應到達腫瘤部位并通過胞吞作用進入腫瘤細胞。腫瘤細胞中溶酶體內的弱酸環境使縮醛鍵斷裂,導致納米顆粒解體并釋放出ROS響應的氮芥前藥和β-拉帕醌。在腫瘤細胞中釋放的β-拉帕醌在醌氧化還原酶1(NQO1)的作用下誘導產生大量的ROS(圖2),進而在ROS的誘導下氮芥前藥被活化,生成抗腫瘤藥物氮芥,活化的氮芥進一步誘導腫瘤細胞凋亡(圖3)。簡而意之,所設計前藥膠束在腫瘤細胞內的“順次誘導”過程為:前藥膠束進入腫瘤細胞 → 腫瘤細胞內的弱酸環境 → 誘導β-拉帕醌釋放 → β-拉帕醌誘導腫瘤細胞內產生大量ROS → ROS誘導激活抗腫瘤藥物 → 腫瘤細胞凋亡。通過該工作的研究,可為進一步研究開發新型的ROS響應性藥物控釋系統提供理論基礎,為傳統方式無法實現的非穩定性藥物輸送提供新思路。

圖2 β-拉帕醌誘導Hela細胞產生ROS的熒光顯微照片

圖3 (A)不同濃度P-Lapa對Hela,A-549,MCF-7和L929細胞的細胞毒性;(B)β-拉帕醌與不同濃度氮芥聯合使用對Hela細胞的細胞毒性;(C)對A-549細胞的細胞毒性;(D)對MCF-7細胞的細胞毒性
以上研究內容以“Tailored Design of an ROS-Responsive Drug Release Platform for Enhanced Tumor Therapy via “Sequential Induced Activation Processes””為題發表在《ACS Applied Materials & Interfaces》上。2016級碩士欒婷婷、2015級碩士程路路、蘭州大學基礎醫學程菊老師為本論文的共同第一作者,蘭州大學趙光輝副教授為論文通訊作者。該課題得到了國家自然科學基金委(Nos. 21772080)、中央高校基本科研業務費(lzujbky-2019-kb06)等項目的資助。
蘭州大學趙光輝副教授團隊長期致力于生物醫用高分子和納米材料的設計合成,圍繞創傷修復和腫瘤的診斷治療,重點開展軟組織的創傷修復材料、止血材料以及藥物輸送研究。研究成果相繼刊發在Polym. Chem., 2018, 9, 1337–1347; Chem. Commun., 2017, 53, 12302–12305; Chem. Asian J. 2017, 12, 176–180等期刊上,為相關領域的發展提供了理論和技術指導。
- 北化樊保民/趙景茂《Corros. Sci.》:MXene賦能新交聯機理構建強耐熱漆酚防護涂層 2025-06-18
- 西南醫大口腔醫院陶剛/黎春暉/蔡蕊團隊:具有ROS觸發藥物釋放特性的可注射水凝膠實現抗菌劑和抗炎納米顆粒協同遞送用于牙周炎治療 2025-04-15
- 華南理工唐本忠院士團隊馮光雪教授/南開丁丹教授 ACS Nano:雙模態ROS刺激的一氧化碳釋放用于光動力和氣體腫瘤的協同治療 2024-11-05
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
- 浙大周民教授團隊 Bioact. Mater.:微藻藥物遞送系統"降尿酸-抗炎-消化系統保護"三位一體協同用于痛風性關節炎的治療 2025-06-04
- 蘇大劉莊/楊光保教授團隊招聘博士后 - 材料合成、納米醫學(腫瘤診療、藥物遞送、免疫治療等) 2025-04-29
- 武漢理工大學戴紅蓮教授課題組 AFM:誘捕細菌聯合磁熱協同殺菌的智能給藥系統高效修復感染性骨缺損 2023-04-02
