本文經授權轉載自公眾號 BioArt。
腫瘤細胞在增殖的過程中,可誘導周圍脂肪細胞的脂滴裂解,釋放游離脂肪酸從而為腫瘤生長提供能量。同時,腫瘤周圍脂肪組織可以釋放激素、炎癥因子等生物活性分子協同促進腫瘤的炎癥環境,并協助腫瘤細胞抵御機體免疫系統的攻擊,進而在腫瘤的增殖、轉移等過程中扮演“幫兇”的角色。研究表明,腫瘤周圍脂肪組織呈現脂肪組織萎縮、纖維化增強、大量巨噬細胞浸潤等特點,其代謝和生物活性分子的表達也異于正常脂肪組織。另外,脂質分子代謝通路是腫瘤對抗化療藥物的耐藥機制之一。因此,腫瘤周圍的脂肪細胞以及脂質代謝通路成為了近來藥物設計的新靶點。

9月26日,加州大學洛杉磯分校(UCLA)的顧臻教授團隊(第一作者溫迪博士)在《細胞》子刊 Matter上發表了題為Adipocyte as Anticancer Drug Delivery Depot的研究論文,利用脂肪細胞來遞送抗癌藥物,提出了利用腫瘤微環境中脂肪酸代謝途徑促進藥物遞送的新思路。團隊在動物模型上驗證,基于脂肪酸代謝途徑設計的一種新型阿霉素(doxorubicin)前藥,可以與共軛亞油酸(rumenic acid)聯用,顯著抑制腫瘤生長及術后腫瘤復發。這一創新成果較為系統地論證了脂肪細胞在抗癌細胞療法上的應用,有望建立腫瘤以及其他脂代謝相關疾病的新型治療技術平臺。

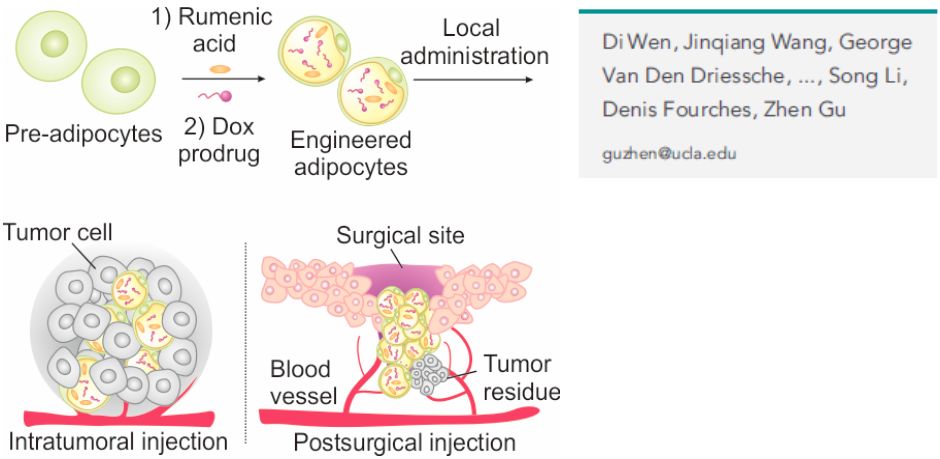
載藥脂肪細胞可通過局部注射作用于腫瘤組織或術后創面中
在這項工作中,研究團隊首次將脂質分子代謝通路用于抗癌藥物遞送,巧妙地利用共軛亞油酸改造脂肪細胞,使得這種抗癌脂肪酸改造后的脂肪細胞能夠抑制腫瘤細胞增殖,并招募機體免疫細胞殺傷腫瘤細胞。與此同時,研究人員設計了響應腫瘤微環境中活性氧(ROS, reactive oxygen species)的阿霉素前藥,通過和脂肪酸分子連接,這種前藥分子降低了對脂肪細胞的毒性,并能在腫瘤細胞里高活性氧的環境中轉變為阿霉素,從而提高對腫瘤細胞的選擇性殺傷效果。改造后的脂肪細胞就像特洛伊木馬,能夠利用癌細胞本身的代謝途徑,實現對癌細胞較為特異性的殺傷。
研究團隊通過計算機模擬以及實驗證明,該前藥分子可以與脂肪酸結合蛋白4(fatty acid binding protein 4)結合,通過“正常脂肪細胞將脂肪酸轉運到癌細胞提供能量”這個代謝途徑轉運到癌細胞內,從而提高了藥物的轉運效率和毒性。并且腫瘤細胞誘發的脂滴分解過程能顯著促進了脂肪細胞中的藥物釋放,使得化療藥物和抗癌脂肪酸能夠隨著游離脂肪酸被釋放到腫瘤微環境中,并通過腫瘤特異性通路被癌細胞吸收。

計算機模擬阿霉素前藥與脂肪酸轉運蛋白結合示意圖
值得一提的是,這種利用腫瘤微環境細胞作為藥物載體的遞藥方式,有望提高化療藥物在腫瘤組織中的吸收,為腫瘤以及其他與脂代謝相關的疾病的細胞療法開辟了新的思路。目前團隊正在嘗試利用類似的方法運送其它抗腫瘤藥物,并同時驗證這種藥物設計策略的其他應用。
原文鏈接:https://doi.org/10.1016/j.matt.2019.08.007- 新技術有望讓人類永久告別皺紋 2017-01-12
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
- 浙大周民教授團隊 Bioact. Mater.:微藻藥物遞送系統"降尿酸-抗炎-消化系統保護"三位一體協同用于痛風性關節炎的治療 2025-06-04
- 蘇大劉莊/楊光保教授團隊招聘博士后 - 材料合成、納米醫學(腫瘤診療、藥物遞送、免疫治療等) 2025-04-29
