與傳統的癌癥治療方法相比,光熱療法和光動力療法因其無創性,有效性和較小的副作用而引起了研究者們極大的興趣。光熱療法(PTT)可以利用光熱納米劑的熱量消融腫瘤。然而,溫度過高會導致熱休克蛋白的過表達,導致癌細胞不能完全凋亡和腫瘤復發,從而削弱PTT效應。另一方面,光動力療法(PDT)可以產生高毒性的單線態氧(1O2),從而殺死癌癥細胞。眾所周知,腫瘤內部具有不同的生理環境。在常氧的腫瘤部位,1O2可以破壞細胞和血管以破壞腫瘤,因此,具有中等光熱作用和強光動力作用的納米劑可能是殺死這些部位的細胞和血管的最佳選擇。另一方面,在致密腫瘤內部形成了缺氧微環境,這限制了PDT的作用,當PDT與PTT結合使用時,高熱可以使致密腫瘤內部的微血管中的氧含量增加,因此,具有強光熱和光動力作用的光療納米平臺可能是消除低氧致密腫瘤內部癌細胞的最佳解決方案。綜上所述,需要對材料的光熱和光動力效應進行精準調控,從而實現腫瘤的精準治療。
在前期工作中,黃輝教授團隊通過分子設計,分別采用重原子效應策略和D-A結構和扭曲構象結合的策略,得到了一系列具有較強光熱效應和光動力效應的有機半導體納米粒子,并且對小鼠腫瘤具有很好的治療效果(Small, 2020, 10.1002/smll.202000909;ACS Appl. Mater. Interfaces, 2019, 19, 17884-17893.)。
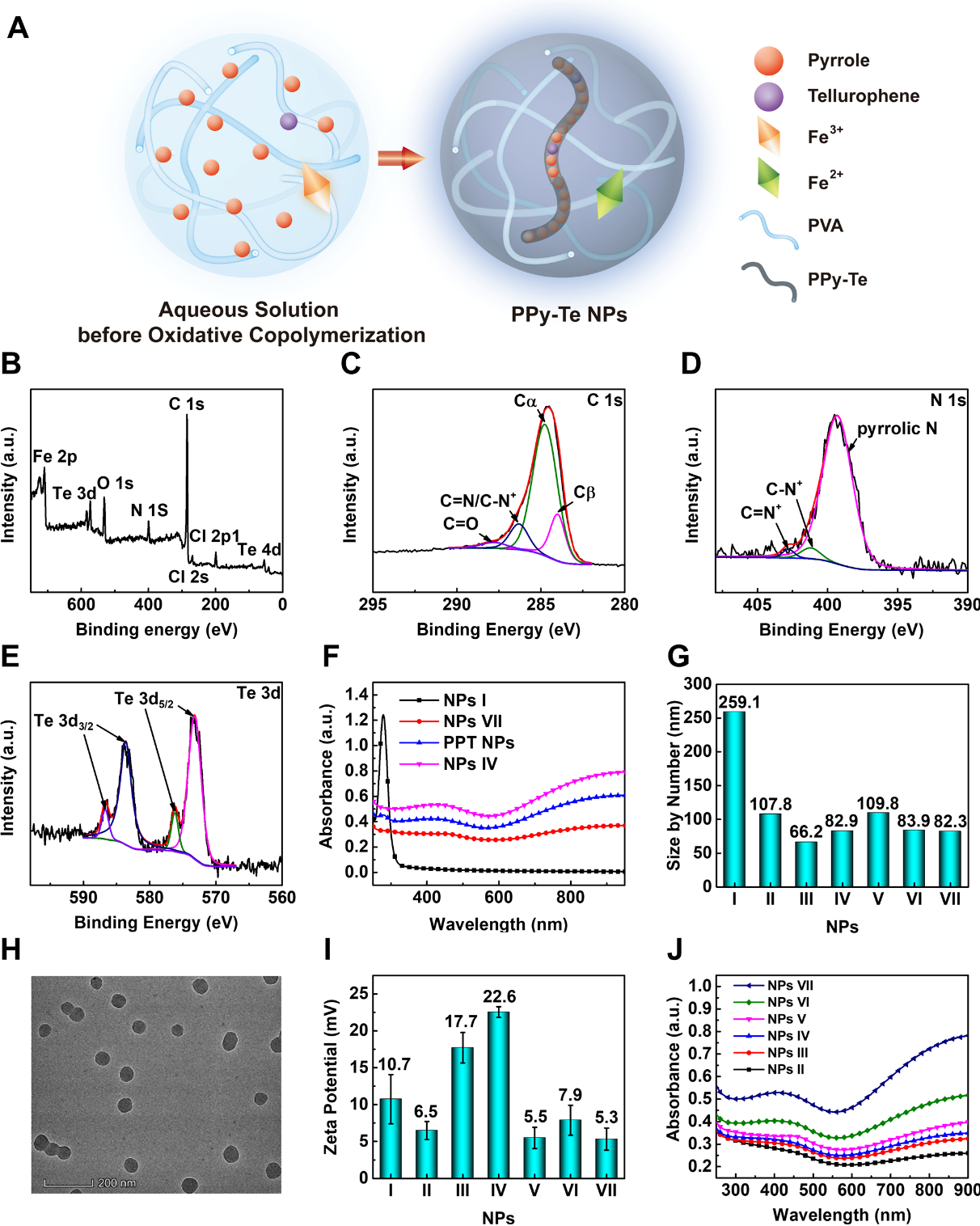
圖1(A)PPy-Te NPs的制備示意圖。(B-E)蝕刻后的NPs IV的全譜和C 1s,N 1s,Te 3d電子的XPS光譜。(F)NPs I,NPs VII,NPs IV和PPT NPs的UV-Vis-NIR吸收光譜(NPs的濃度為100μg mL-1)。(G)通過DLS測量的NP I-VII的大小。(H)NPs的TEM圖像 比例尺,200 nm。(I)通過DLS測量的NPs I-VII的ζ電勢。(J)NP II-VII(100μg mL-1)的UV-Vis-NIR吸收光譜。
為了進一步實現光熱與光動力學效應的精準調控,黃輝教授帶領的研究團隊通過受控氧化共聚,原位合成了一系列具有不同比例的吡咯與碲吩的共聚物納米顆粒。通過X射線光電子能譜以及紫外可見近紅外光譜證實了碲吩和吡咯原位共聚合反應的實現。進一步系統研究發現,隨著吡咯比例的提高,光熱轉換效率依次提高,隨著碲吩比例的提高,活性氧物種產率增加。因此,通過改變吡咯與碲吩的摩爾比,可以精確而系統地調節半導體納米劑在近紅外一區激光輻射下的光熱和光動力效應。動物實驗表明,該類納米粒子對腫瘤具有高效的治療效果,并且具有良好的生物相容性。因此,這項工作提出了一種簡單的方法來調節有機半導體納米粒子的光熱和光動力效應,并成功應用到腫瘤治療中。

圖2(A)NPs II-VII(100μg mL-1)和H2O的溫度變化曲線。(B)最高溫度下NPs II-VII的紅外熱圖像和由圖2A計算得出的NPs II-VII的PCE。(C)NPs II-VII中吡咯含量與PCE,活性氧物種(ROS)產率之間的擬合線。(D)NPs IV光照五個周期的(100μg mL-1)的溫度變化曲線。
相關研究成果以《Precisely Tuning Photothermal and Photodynamic Effects of Polymeric Nanoparticles by Controlled Copolymerization》為主題,發表在化學材料領域著名期刊《Angewandte Chemie International Edition》 (Angew. Chem. Int. Ed. ) 上(DOI: 10.1002/anie.202004181)。論文的第一作者為中國科學院大學材料科學與光電技術學院博士生溫凱凱,共同第一作者為西南科技大學碩士生吳麗芬,通訊作者為黃輝教授和西南科技大學段濤教授。另外,該工作還得到中山大學第五附屬醫院馬寒教授在動物實驗上的大力支持。
論文鏈接:
https://onlinelibrary.wiley.com/doi/10.1002/smll.202000909
https://pubs.acs.org/doi/10.1021/acsami.9b05196
https://onlinelibrary.wiley.com/doi/10.1002/anie.202004181
- 天工大高輝/馬飛賀/余云健 Small:疏水標簽/低溫光熱協同增強腫瘤治療 2025-07-11
- 東華大學郭睿教授/史向陽教授課題組《ACS AMI》:樹枝大分子包裹銅鉑雙金屬納米酶用于腫瘤微環境調控光熱/催化療法 2025-06-19
- 清華危巖、川師大白躍峰《npj Clean Water》: 高效光熱轉化聚合物水蒸發器助力水資源與鋰資源雙豐收 2025-06-06
- 西安交大郭保林/梁永平團隊 AFM:光熱/光動力協同抗菌與 pH/葡萄糖雙重響應藥物遞送治療糖尿病足潰瘍 2024-11-21
- 華南理工唐本忠院士團隊馮光雪教授/南開丁丹教授 ACS Nano:雙模態ROS刺激的一氧化碳釋放用于光動力和氣體腫瘤的協同治療 2024-11-05
- 香港中文大學(深圳)唐本忠院士團隊 ACS Nano:基于AIEgen的可見光穿透器用于深層組織感染的光動力治療 2024-10-21
- 蘇大鐘志遠/鄧超、蘇大附一院朱曉黎 Nat. Commun.:腫瘤血管適應性、粘附性和可吸收性微球用于可持續的經動脈化學栓塞治療 2025-07-09
