生物材料的可降解性給其臨床應用帶來了許多機遇,但同時也面臨著諸多的挑戰。特別是,可降解生物材料的體內降解行為對其體內功能的實現扮演著至關重要的角色。復旦大學聚合物分子工程國家重點實驗室俞麟教授與上海第十人民醫院彭琛副研究員合作開發了一種三模式生物成像技術,能夠用于實時監測合成聚合物在體內的降解行為,并以具有臨床應用潛力的可注射的PLGA-PEG-PLGA熱致水凝膠作為演示材料驗證了該多模式成像技術。
團隊分別設計合成了一種大分子熒光探針和一種磁共振成像造影劑。體外流變學測試表明,兩種探針的引入不影響PLGA-PEG-PLGA熱致水凝膠體系的凝膠化行為。在小鼠皮下注射載有兩種探針的PLGA-PEG-PLGA水凝膠后,能夠通過超聲、熒光和磁共振成像三者協同地示蹤凝膠在體內的降解過程。將無損成像示蹤與傳統解剖觀察相結合后,首次提出PLGA-PEG-PLGA熱致水凝膠體內降解過程的三階段機理:PLGA-PEG-PLGA熱致水凝膠體內降解的第一階段由表面溶蝕控制,隨后轉變為表面溶蝕與PLGA嵌段水解相結合的降解機制,而最后一階段降解則由殘余的PLGA嵌段水解機制起主導作用。在整個體內降解過程中,凝膠的含水量由于溶脹先呈現短暫上升,然后持續下降直到一個恒定的水平。研究還發現,溶蝕的PLGA-PEG-PLGA聚合物及其降解產物主要通過肝、膽和脾臟進行消除。因此,該研究不僅深入地揭示了PLGA-PEG-PLGA熱致水凝膠在體內的降解過程,而且有助于推動該類水凝膠未來的臨床應用。
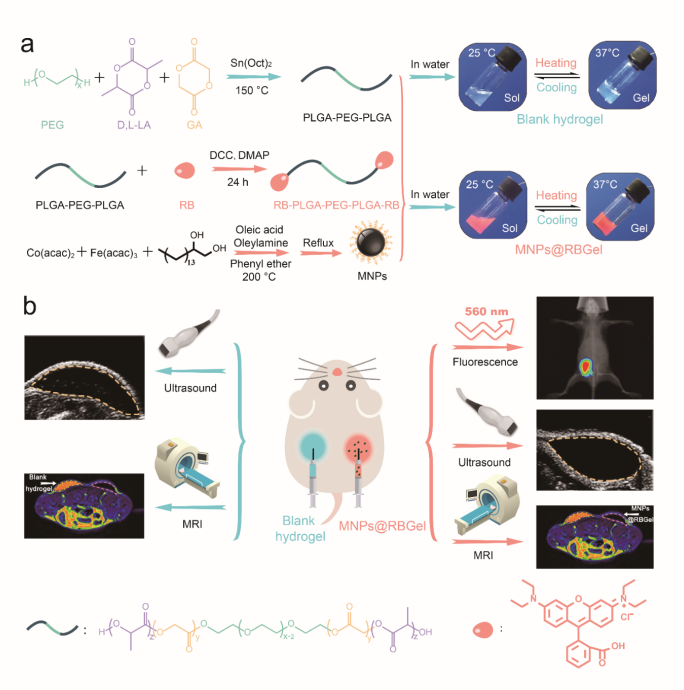
同時,該研究開發的多模態生物成像技術除了能夠提供材料的形態學變化和代謝途徑等信息之外,還可以無損地觀察材料周圍組織的炎癥反應。進一步考慮到所使用的大分子熒光探針和磁性納米顆粒具有合成簡單、封裝方便等優點,故該平臺技術還很容易拓展并應用于其它可降解生物材料中。
該研究成果以“Visualizing the in vivo evolution of an injectable and thermosensitive hydrogel using tri-modal bioimaging” 為題,發表于Small Methods 2020, 2000310,文章的第一作者為復旦大學高分子科學系博士生陳曉斌,俞麟教授和彭琛副研究員為通訊作者,丁建東教授為共同作者。該研究得到了國家自然科學基金和科技部重點研發項目的資助。
文章鏈接:https://onlinelibrary.wiley.com/doi/full/10.1002/smtd.202000310#
- 復旦大學俞麟教授:負載替考拉寧的可注射性PLGA-PEG-PLGA熱致水凝膠敷料用于皮膚傷口的加速愈合 2019-01-17
- 復旦丁建東教授課題組《Adv. Funct. Mater.》:基于熱致水凝膠的研究發明治療/預防一體式腫瘤疫苗 2022-09-14
- 復旦大學丁建東教授課題組揭示熱致水凝膠的微觀結構與普適機制 2019-05-20
- 復旦大學丁建東教授課題組揭示熱致水凝膠的結構及物理凝膠化機理 2018-11-13
