近日,西南交通大學材料學院周紹兵教授團隊在抗腫瘤以及抑制腫瘤轉移方面取得最新研究進展。相關研究成果以“Development of a pH-responsive polymersome inducing endoplasmic reticulum stress and autophagy blockade”為題,發表在綜合性頂級期刊《Science Advances》上,徐傅能博士為論文第一作者,周紹兵教授為論文通訊作者。
納米藥物在腫瘤治療中因其可以解決藥物水溶性差、副作用大的問題而成為抗腫瘤研究的熱點,通常納米藥物攜帶的化療藥物都是以細胞核DNA為靶點進行抗腫瘤治療,而僅存在于細胞核DNA的核苷酸切除修復機制可修復化療藥物產生的DNA損害,削弱其抗腫瘤效果。同時,與多細胞器關系密切的必要且保守的生理分解代謝過程-自噬,與細胞的命運以及腫瘤的發生、發展都緊密相關。因此,以非細胞核DNA為靶點的,調控細胞中重要細胞器達到自噬調控目的的抗腫瘤研究不失為一種新的策略。
鑒于此,周紹兵團隊設計制備了一種pH響應的聚合物囊泡,可同時向腫瘤細胞遞送衣霉素(Tuni)和羥基氯喹(HCQ),實現內質網應激和自噬流阻斷,提高抗腫瘤效果和抑制腫瘤轉移。聚合物囊泡通過內吞進入細胞,聚(β-氨基酯)作為囊泡疏水鏈段,因其重復的叔胺基團在溶酶體酸性環境中迅速質子化而變得親水,這一pH響應過程一方面堿化破壞溶酶體,協同HCQ的溶酶體脫酸化作用,共同達到對大范圍內溶酶體的破壞;另一方面,導致了囊泡結構的崩解,達到刺激響應快速釋藥的目的。釋放出的Tuni導致內質網應激的發生,調控PERK/Akt/mTOR信號通路,提高細胞內以自噬體、自噬溶酶體以及自噬相關蛋白LC-Ⅱ為特征的自噬水平的提高。而溶酶體被破壞使自噬流無法最終完成,產生的特殊的“自噬性壓力”,而取得良好的抗腫瘤效果(圖1)。

圖1 聚合物囊泡的抗腫瘤評價
同時,存在于細胞膜上的跨膜蛋白集合-黏著斑的更替速率限制了腫瘤的轉移速率,自噬流被阻斷極大限制了黏著斑的更替;內質網應激相關信號通路的改變也導致了腫瘤轉移的重要幫手-基質金屬蛋白酶-2的分泌減少,在兩者的共同作用下,小鼠乳腺癌的典型轉移部位-肺部的轉移被有效抑制(圖2)。
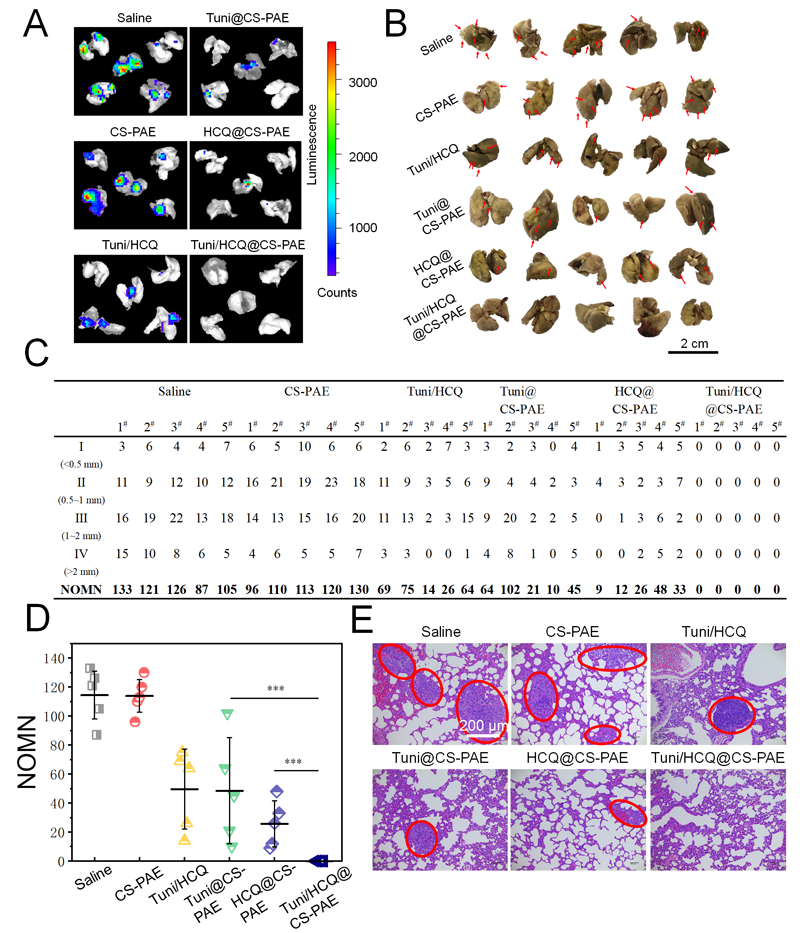
圖2 聚合物囊泡的腫瘤轉移抑制評價
原文鏈接:https://advances.sciencemag.org/content/6/31/eabb8725
- 四川大學李建樹教授/謝婧副研究員、大連理工孫文研究員 AFM:一種具有pH響應性和軟骨滲透能力的超分子納米顆粒治療骨關節炎 2025-04-30
- 中山大學腫瘤醫院楊江教授 JCR:可吸入式pH響應型電荷反轉聚合物-siRNA復合物用于ALK融合陽性肺癌靶向基因治療 2025-03-31
- 武漢紡織大學任學宏教授團隊 CEJ:具有pH響應轉換雙重酶活性的納米纖維用于抗菌及過氧化氫檢測 2025-02-18
- 華東理工林紹梁/靳海寶團隊、上海交大周永豐 Angew:通過調節偶氮苯對位取代基的電子效應制備具有可控光響應性的超薄聚合物囊泡 2025-02-22
- 四川大學丁明明和譚鴻教授團隊Angew:高分子構象轉變調節囊泡膜通透性 2021-08-19
- 巴黎高科化學學院李敏慧教授與浙江大學凌君教授合作報道:氧化響應的聚類肽囊泡 2019-08-26
- 復旦大學占昌友教授團隊《Nano Today》:親和誘捕法實現生物介質中PEG化聚合物膠束的高效分離-破譯聚合物膠束的體內命運 2024-04-25
