骨關(guān)節(jié)炎(Osteoarthritis,OA)是一種以關(guān)節(jié)軟骨退化和滑膜炎癥為特征的慢性退行性骨骼疾病,會增加軟骨表面摩擦和磨損的風(fēng)險,嚴(yán)重影響患者的生活質(zhì)量。現(xiàn)有療法如抗炎藥物或透明質(zhì)酸注射雖能緩解癥狀,但難以應(yīng)對關(guān)節(jié)內(nèi)復(fù)雜的酸性微環(huán)境、氧化應(yīng)激及深層軟骨修復(fù)等挑戰(zhàn),限制了其整體治療效果。因此,亟需開發(fā)一種多模態(tài)治療策略,全面重塑骨關(guān)節(jié)炎微環(huán)境并恢復(fù)軟骨穩(wěn)態(tài),實現(xiàn)對OA的精準(zhǔn)調(diào)控和高效治療。

針對上述問題,研究團隊設(shè)計了一系列潤滑性高分子材料以提高關(guān)節(jié)腔注射材料的長效穩(wěn)定性和生物功能性,主要包括:兩性離子光熱納米酶(Adv. Mater., 2023, 35, 2303299)、環(huán)刷狀兩性離子聚合物(Mater. Horiz., 2023, 10, 2554-2567)和定制化聚合物盔甲(Mater. Horiz., 2024, 11, 5352-5365。針對關(guān)節(jié)炎的復(fù)雜微環(huán)境和軟骨天然的電場屏障,研究團隊近期報道了一種具有pH響應(yīng)性和深層軟骨穿透能力的超分子聚兩性離子納米顆粒(PSBMA-b-PColBP@KGN,PSPK),為骨關(guān)節(jié)炎治療提供了全新策略(圖1)。
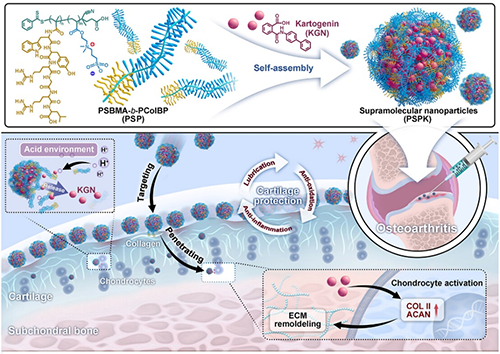
圖1 超分子聚兩性離子納米顆粒(PSPK NPs)的制備和作用機制示意圖。
PSPK NPs是由兩性離子嵌段共聚物(PSBMA-b-PColBP,PSP)和具有軟骨誘導(dǎo)作用的小分子藥物Kartogenin(KGN)通過超分子組裝得到。這種超分子組裝下的動態(tài)相互作用賦予了納米顆粒pH響應(yīng)性,在OA弱酸性微環(huán)境(pH 6.0)中,KGN在72 h內(nèi)的釋放率可達(dá)到91.60%(圖2)。

圖2 聚合物PSP與藥物分子KGN的組裝過程的分子動力學(xué)模擬、TEM圖和pH響應(yīng)性藥物釋放。
基于兩性離子單元的水合能力,PSPK NPs在高載荷(10.41 MPa)和高頻率(3 Hz)的測試條件下體現(xiàn)了優(yōu)異潤滑性(COF = 0.028)和耐磨性(圖3)。此外,通過尺寸效應(yīng)、pH響應(yīng)性電荷轉(zhuǎn)變和對Col II特異性親和力的協(xié)同作用下,PSPK NPs能克服軟骨屏障,在48 h內(nèi)實現(xiàn)約300 μm的軟骨組織滲透,將藥物遞送至軟骨深層。

圖3 PSPK NPs的潤滑性能和軟骨穿透能力。
體內(nèi)研究也證實了PSPK NPs在恢復(fù)軟骨穩(wěn)態(tài)方面的潛力,主要表現(xiàn)為骨贅體積的減少、軟骨結(jié)構(gòu)整齊排列以及軟骨基質(zhì)的有效再生(圖4)。總而言之,具有pH響應(yīng)功能的PSPK NPs有效結(jié)合了穩(wěn)定潤滑性和深層軟骨穿透性,為重塑OA病理微環(huán)境、恢復(fù)軟骨穩(wěn)態(tài)提供了一種有效的生物手段。
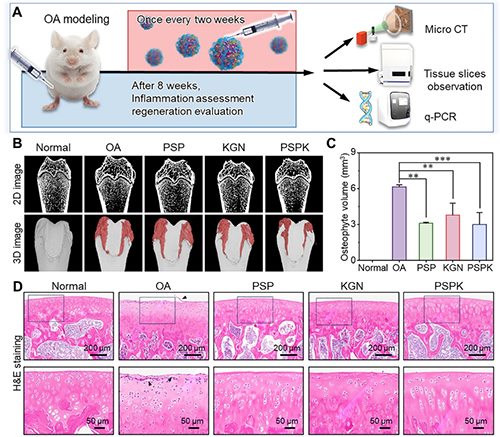
圖4 PSPK NPs對OA大鼠的體內(nèi)治療作用。
相關(guān)研究以“Supramolecular Polyzwitterionic Nanoparticles with Engineered pH-Responsiveness and Cartilage-Penetration for Osteoarthritis Therapy”為題發(fā)表在《Advanced Functional Materials》上,四川大學(xué)李建樹教授和謝婧副研究員、大連理工大學(xué)孫文研究員為該論文的共同通訊作者。四川大學(xué)高分子學(xué)院2022級碩士研究生丁少沛和俞鵬博士為該論文的共同第一作者,該研究成果已授權(quán)中國發(fā)明專利(專利號ZLZL202110412807.6和ZL202110413881.X)。該項工作得到國家自然科學(xué)基金(U22A20158、22402022、52473311)和四川省科技計劃項目(2025ZNSFSC0338、2024NSFSC1017)等的支持。
課題組主頁鏈接:https://jianshu-scugroup.com/
原文鏈接:https://doi.org/10.1002/adfm.202505638
- 長沙理工大學(xué)張躍飛/李焰課題組 CES:pH響應(yīng)性PHGC/MXene水凝膠在染料廢水處理中的應(yīng)用 2024-10-08
- 華東理工大學(xué)王庚超教授/王文強團隊 Angew:電泳驅(qū)動可控相分離制備強韌型介孔殼聚糖電解質(zhì)膜 2024-01-22
- 華中科技大學(xué)王艷教授團隊《Adv. Funct. Mater.》:基于硼酸酯pH響應(yīng)性的可再生抗菌納濾分離膜 2023-03-28
- 天工大高輝教授團隊《Small Methods》:遠(yuǎn)程可控的超分子納米藥物為Fn相關(guān)耐藥結(jié)直腸癌提供有效治療策略 2023-11-30
- 東華大學(xué)沈明武研究員/史向陽教授團隊:不對稱含磷樹狀大分子遞送菠蘿蛋白酶用于骨關(guān)節(jié)炎的抗炎和軟骨保護治療 2025-06-13
- 浙江大學(xué)周民團隊《ACS Nano》:螺旋藻外泌體水凝膠用于骨關(guān)節(jié)炎治療 2025-02-25
- 川大張興棟院士團隊王啟光/樊渝江:自潤滑雜化外泌體微凝膠通過體內(nèi)靶向Foxo3基因編輯調(diào)控軟骨細(xì)胞線粒體自噬以緩解骨關(guān)節(jié)炎進展 2025-01-24
