抗生素耐藥性目前對全球公眾健康以及經濟發展產生了巨大威脅。為了發展出低耐藥性的抗菌藥物,許多研究者將目光投向了膜靶向的抗菌高分子化合物。這一領域先前的研究主要集中在抗菌聚合物的結構篩選和構效關系研究上,以期能夠獲得具有更好治療指數(TI)的聚合物。這些研究取得了很多成果,但由于真核細胞和細菌細胞膜結構的相似性,很難保證這些抗菌高分子完全不破壞真核細胞的細胞膜,因此這類抗菌劑的應用和開發受到了很大的限制。
針對這一問題,馮欣欣、白玉罡教授課題組利用細菌DNA位于無膜保護的擬核中,而真核生物的DNA受到核膜的保護這一物種差異性,提出了“雙重機理”策略來提升抗菌高分子的選擇性,即在抗菌聚合物的分子結構中引入除細胞膜以外靶向細菌DNA的第二重抗菌機制,這種額外的、具有更好選擇性的抗菌機制能同膜靶向機制結合起來,在保證抗菌效果的前提下降低其真核細胞毒性。基于此,該課題組率先報導了一種寡聚脒類聚合物,該寡聚物能夠選擇性地破壞細菌細胞膜的完整性,同時選擇性地只與細菌DNA結合,從而通過雙重選擇性機理得到更高的治療指數。
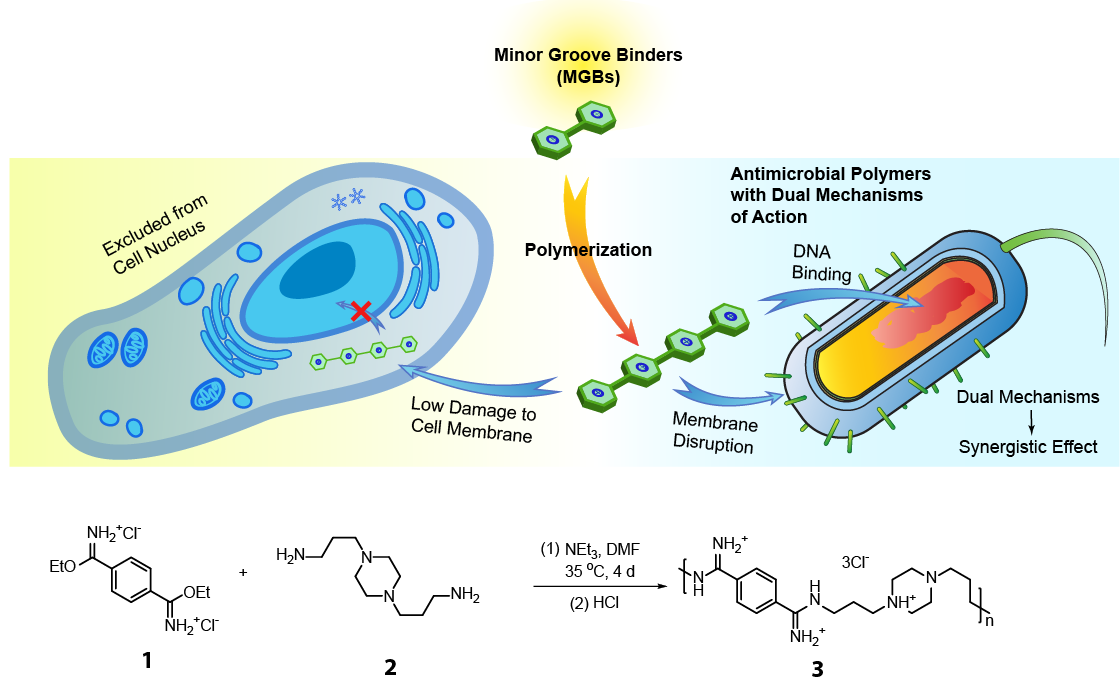
抗菌寡聚脒類聚合物的設計與合成。
首先,該研究團隊選擇了雙脒結構作為結合DNA溝槽結構,從而獲得了一個既提供陽離子,也能夠綁定DNA溝槽的聚合物。同時,這種通過縮聚方式合成的寡聚脒的分子量也足夠大,令其無法進入真核細胞的細胞核。該團隊利用對苯二甲亞胺酸乙酯和各種二胺縮聚合成了一系列寡聚脒類聚合物,經過初步的抗菌以及溶血性能篩選,從一系列的寡聚物中選擇了效果最好的化合物——寡聚物3進行進一步的研究。經過一系列耐藥性細菌的抑菌以及殺菌實驗和細胞毒性實驗,研究團隊進一步確定了寡聚物3在體外具有優異的抗菌活性以及生物安全性。
隨后,研究團隊對寡聚物3的抗菌機理進行了深入研究。通過SEM、流式細胞術、進胞機理等一系列實驗,確定了寡聚物3可以選擇性地破壞細菌的細胞膜。隨后利用DNA拯救實驗、熒光競爭實驗以及計算化學方法等進一步證明了寡聚物3能夠特異性結合DNA小溝。

(A) 寡聚物3處理大腸桿菌(K12)(上)和MDR Acinetobacter baumannii -1(下)有明顯的膜損傷 (B)大腸桿菌和3T3細胞的碘化丙啶(PI)膜透性試驗表明寡聚物3選擇性破壞細菌細胞膜。(C)寡聚物3的細胞內化機制。(D) 外源添加DNA抑制寡聚物3的活性。(E) 熒光競爭實驗表明寡聚物 3能夠結合DNA小溝槽.
在證明了寡聚物3能夠選擇性破壞細菌細胞膜以及結合DNA后,研究團隊對寡聚物3在細菌和真核細胞的DNA選擇性上又進行了深入的研究。通過熒光標記的寡聚物3在細菌和哺乳動物細胞中的分布,研究團隊證明了寡聚物3能夠特異性與細菌DNA結合,同時無法進入哺乳動物細胞核。并且研究團隊更進一步通過RT-PCR實驗、轉錄組分析以及Western blot實驗在轉錄和翻譯層面證明了寡聚物3的選擇性。
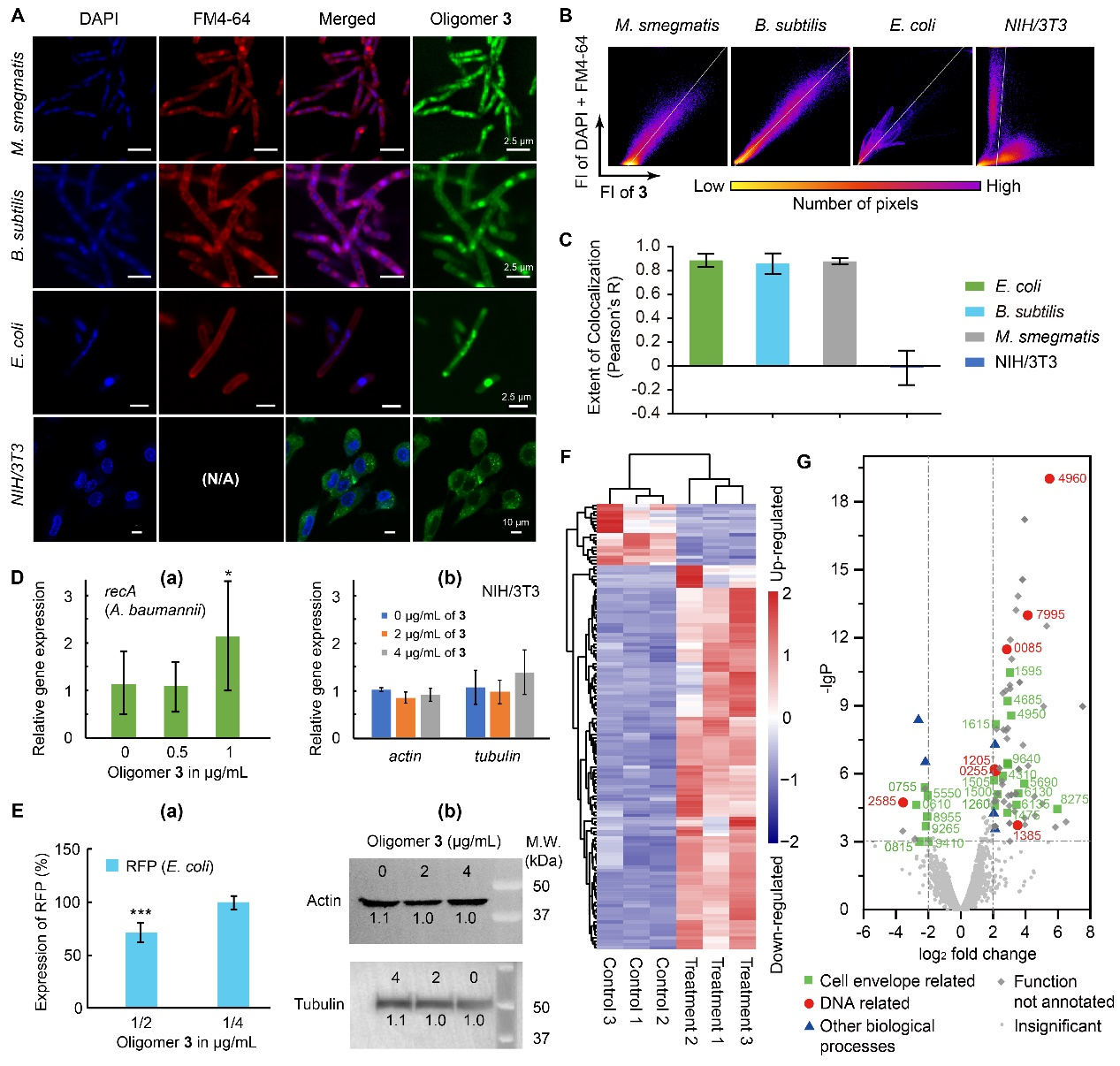
(A) DAPI、FM4-64和3-FITC染色的細菌和哺乳動物細胞共聚焦顯微圖像。(B)染色細菌和哺乳動物細胞的二維熒光強度直方圖。(C)膜和DNA染色與3-FITC染色的Pearson’s相關系數R。(D) 寡聚物3選擇性激活細菌內的管家基因。(E) 寡聚物3選擇性抑制細菌蛋白表達。(F) 鮑曼不動桿菌經寡聚物3處理后的差異表達分析熱圖。(G)鮑曼不動桿菌經寡聚物3處理后的轉錄組結果火山圖。
研究團隊在后續的一系列復雜感染模型中,包括細胞感染、血液感染等都證明了寡聚物3能夠有效殺滅復雜模型中的細菌同時保護細胞不受傷害。同時,由于寡聚物3仍然具有膜靶向機理,它和傳統抗菌聚合物一樣,具有不易產生耐藥性這一特性。在后續的動物實驗中,研究團隊嘗試了線蟲感染模型、小鼠皮膚膿腫模型以及小鼠外切傷口模型,這些實驗結果均證明寡聚物3能夠有效殺滅創面和動物體內的細菌,大大提高受到嚴重細菌感染的動物的存活率,并且在治療過程中未對動物機體產生明顯的毒性。
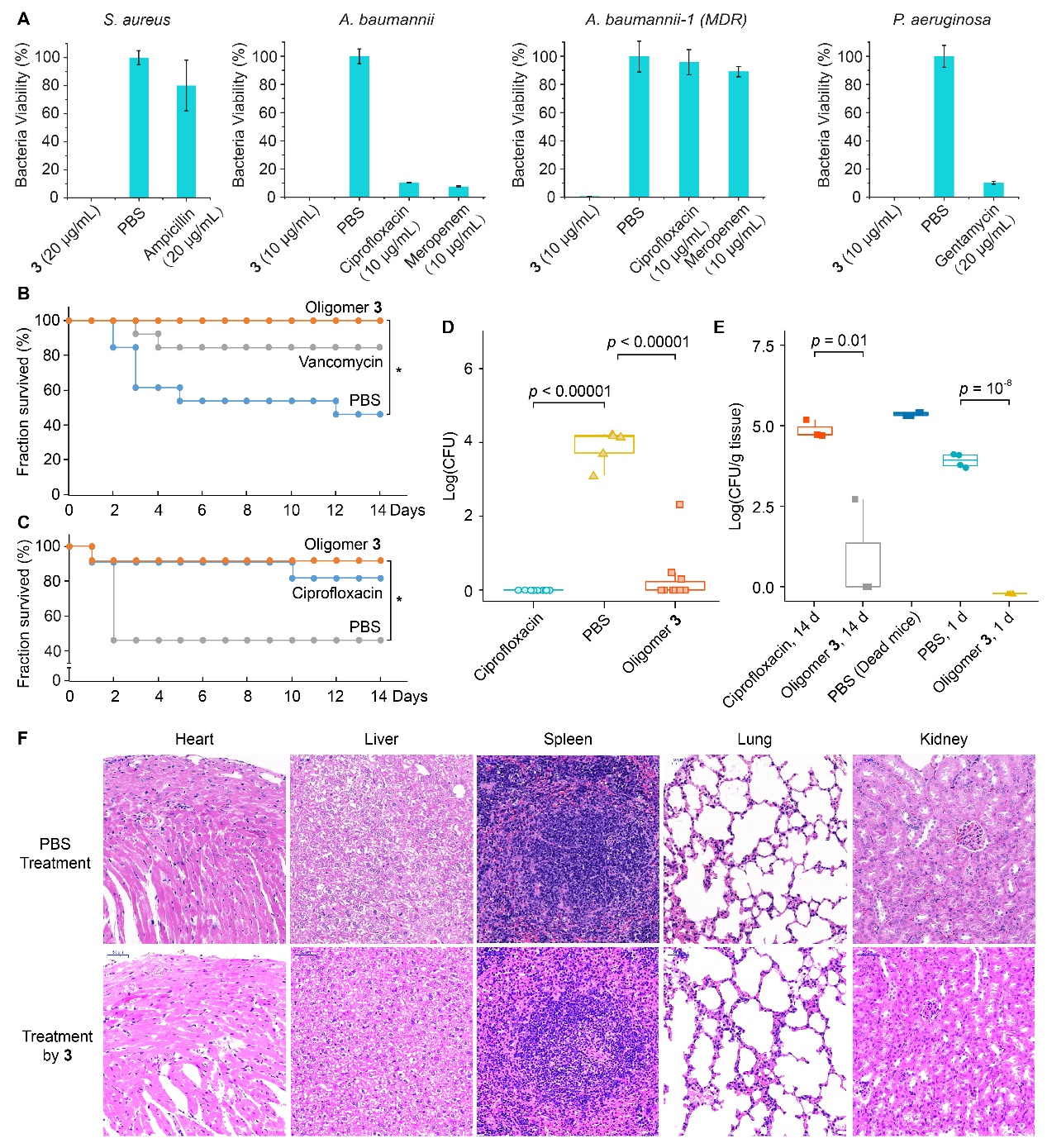
(A)寡聚物3在不同細菌的線蟲感染模型中療效。(B) 小鼠皮膚膿腫感染模型中不同藥物處理的存活率。(C)小鼠外切傷口模型中不同藥物處理的存活率。(D) 小鼠外切傷口模型中,寡聚物3能顯著減少感染區域的細菌數量。(E) 小鼠外切傷口模型中,寡聚物3可以有效地抑制被感染老鼠各個器官中的細菌繁殖。(F)組織免疫組織學切片圖像。
總體來說,該研究團隊通過合理結構設計,成功開發出了首例具有雙重選擇作用機制的抗菌寡聚脒類聚合物,為具備高性能、低毒性、低耐藥性的抗菌高分子的開發提供了新的策略。以上研究成果發表在Science Advances 上(DOI: 10.1126/sciadv.abc9917)。論文的第一作者為湖南大學化學化工學院馮欣欣、白玉罡課題組聯培博士生白思蕾,共同第一作者為湖南大學化學化工學院白玉罡課題組博士生王建雪,湖南大學生物學院馮欣欣課題組碩士生楊凱玲,通訊作者為湖南大學化學化工學院馮欣欣副教授和白玉罡教授。
原文鏈接:https://advances.sciencemag.org/content/7/5/eabc9917
- 西工大李鵬教授/王騰蛟副教授 AFM:硒化氫氣體遞送抗菌高分子納米材料 2025-01-03
- 北京化工大學徐福建教授課題組《AFM》:脂肪酶響應性抗菌高分子材料方面取得新進展 2021-02-26
