多重耐藥(MDR)細菌即所謂“超級細菌”(Superbug)的出現,使人類面臨對MDR細菌感染無藥可治的窘境。同時,由于細菌可以侵入動物細胞并且在其中存活,被感染細胞的細菌成了“特洛伊木馬”,不僅保護細菌逃逸免疫清除和抗菌藥物殺傷,有助于細菌從最初感染部位向其他健康組織擴散。傳統抗菌藥物很難對此類胞內菌實現有效殺傷,導致臨床上病原菌呈現持續感染、反復發作等特征。為了更好地治療胞內MDR細菌感染,迫切需要開發新型抗菌藥物和治療策略。前期研究發現聚集誘導發光材料(AIEgens)在具有很好的抗菌活性,但其作用機制尚不清楚,且缺乏治療胞內感染研究。
近日,香港科技大學、深圳大學唐本忠院士團隊與中國農業大學沈建忠院士團隊朱奎教授合作以“Efficient Killing of Multidrug-Resistant Internalized Bacteria by AIEgens in Vivo”為題在Advanced Science發表最新研究進展,揭示AIEgens單獨抗菌作用及其增強宿主細胞抗菌的分子機制。在前期工作的基礎上(Small Methods, 2020,2000046),選取作用于革蘭陽性菌效果較好的TBPs(TBP-1和TBP-2)作為研究對象,發現TBPs靶向識別金黃色葡萄球菌細菌內膜的磷脂酰甘油(PG)和心磷脂(CL)(圖1)。此外,在30天耐藥性連續誘導試驗中發現TBPs沒有產生耐藥性,遠優于陽性對照藥物Oxacillin。這些結果表明TBPs作用靶點明確且不易產生耐藥性是較理想的抗菌先導化合物。
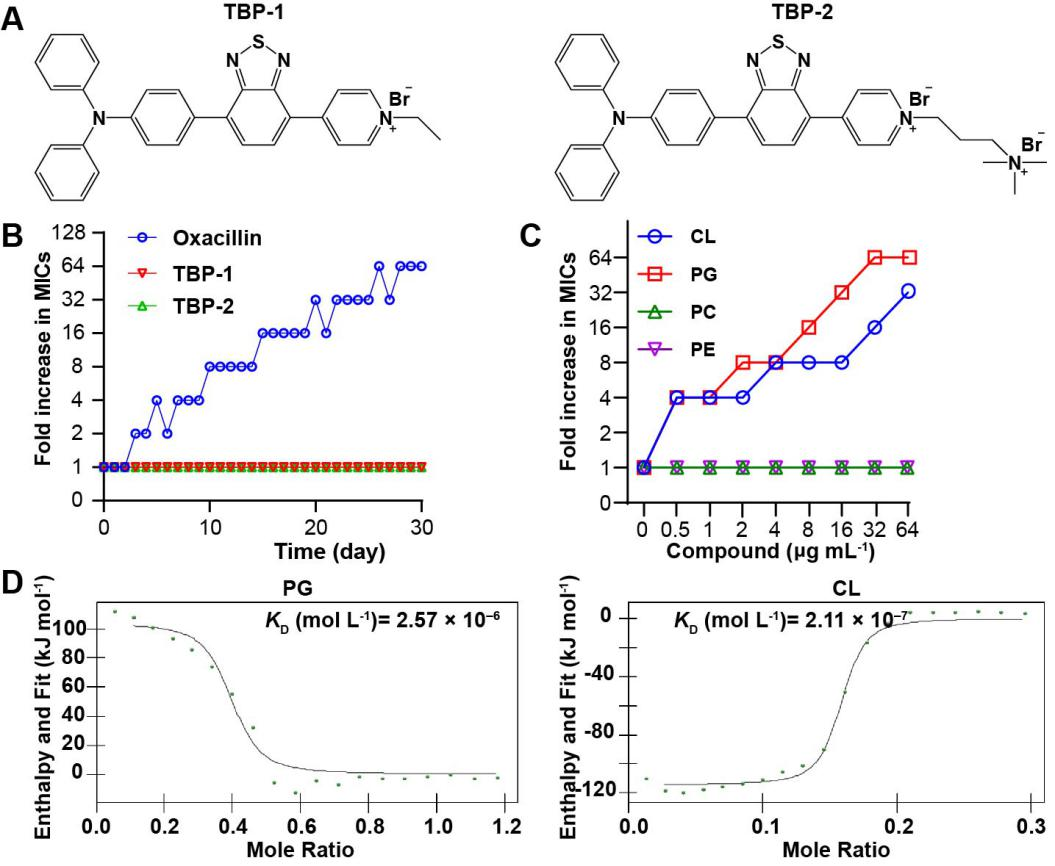
圖1. TBPs靶向識別細菌內膜的磷脂分子
為進一步探究TBPs對胞內細菌的殺傷能力,作者首先進行胞內殺菌實驗,發現TBPs呈現濃度依賴性地殺死胞內菌。隨后以TBP-1為例進行胞內抗菌機制研究,發現TBPs能夠促進線粒體ROS的釋放,升高細胞內ROS水平,促進細胞自噬,清除胞內細菌(圖2)。此外,TBP-1能夠在溶酶體內累積,提高溶酶體內細菌的清除效率。小鼠腹膜炎感染模型表明TBPs能夠顯著地降低小鼠死亡率和臟器內的細菌載量。整體來說,TBPs對小鼠的腹膜炎模型具有很好的治療效果,為治療細胞內細菌的新型抗菌藥物研發提供新思路。
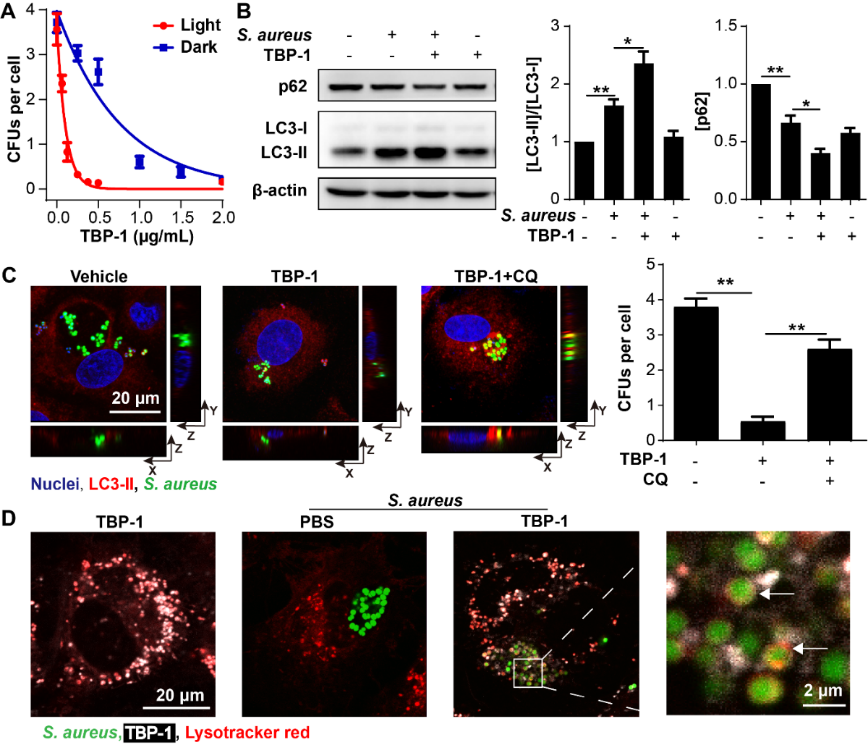
圖2. TBP-1增強自噬促進細胞內金黃色葡萄球菌的清除
綜上所述,作者發現TBPs不僅對能夠靶向胞外細菌膜上的PG和CL,促進細菌ROS產生破壞細菌的膜結構來達到殺菌目的,還可以通過促進細胞自噬促進細胞內細菌的清除(圖3)。該研究揭示AIEgens抗菌作用的分子機制,豐富了宿主導向抗菌藥物開發的藥源分子,為新型AIEgens的分子設計提供新思路。
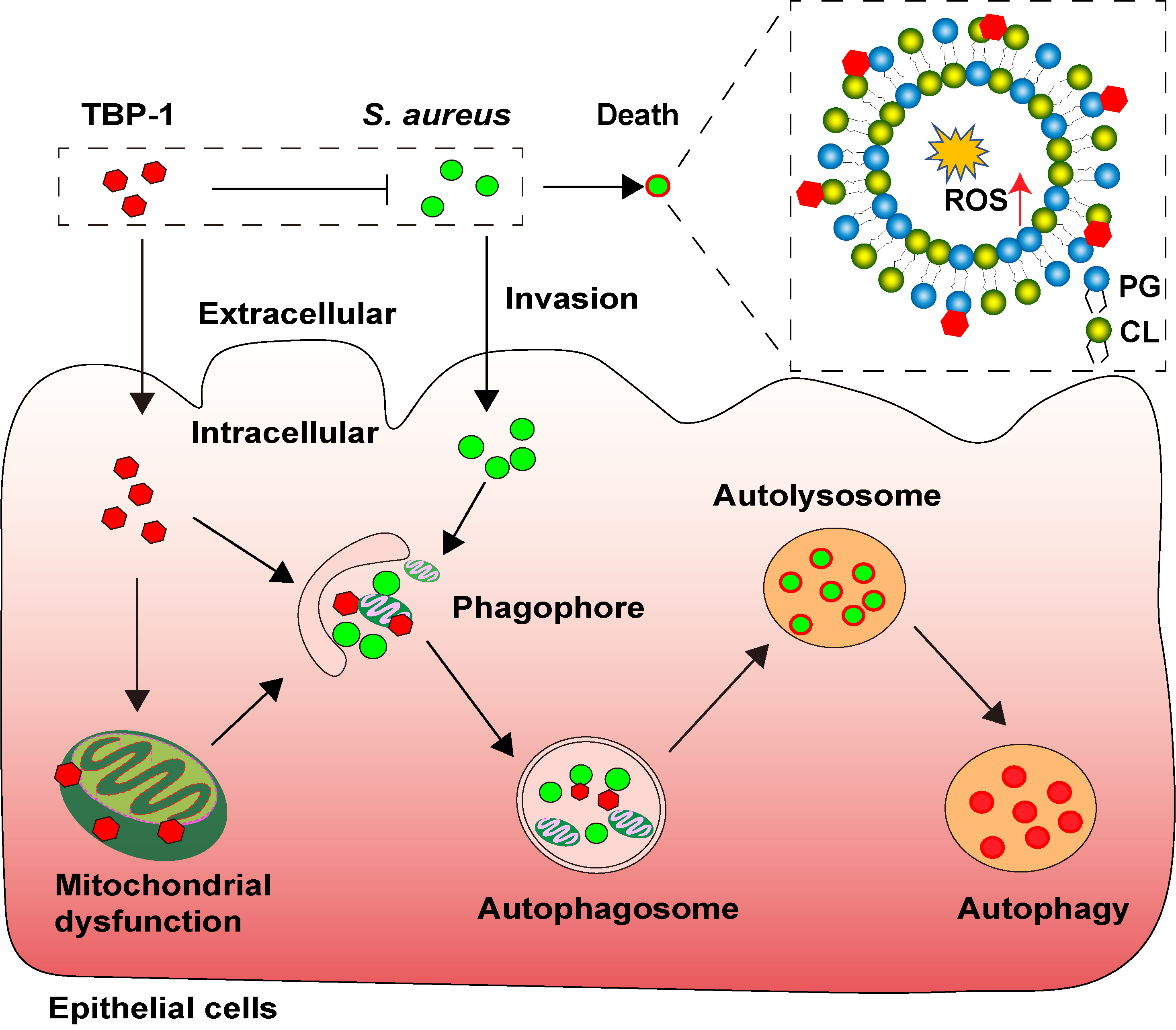
圖3. TBPs抗菌示意圖
論文的第一作者為深圳大學李瑩副研究員與中國農業大學博士生劉飛(共同第一作者),通訊作者為唐本忠院士與中國農業大學朱奎教授。本研究獲得了國家重點研發計劃(2017YFC1600305)、國家自然科學基金(31772796, 22005195)等項目資助。
論文鏈接:http://doi.org/10.1002/advs.202001750
- 香港中文大學(深圳)唐本忠院士/趙征教授團隊《ACS Nano》:細胞膜靶向的聚集誘導發光分子用于神經追蹤和損傷的可視化 2025-01-21
- 香港中文大學(深圳)唐本忠院士與趙征教授團隊《ACS Nano》綜述:聚集誘導發光材料實現高分辨生物成像 2025-01-07
- 港中深唐本忠院士/北理工黎朝 AM:基于AIE活性納米復合水凝膠的可穿戴交互式信息-傳感材料 2024-03-23
- 中山大學顧林課題組 CEJ:在無需外加AIEgens的情況下,利用商業化聚酰胺固化劑的簇發光性質實現環氧涂層自主損傷檢測 2024-09-26
- 港科大唐本忠/浙大張浩可 Nat. Commun.:含雜環AIEgens鄰近效應的調控 2023-07-21
- 北化潘凱研究員、顧星桂教授團隊合作《Small》:具有白光發射和多重刺激響應的 Janus- AIE 納米纖維 2022-05-24
- 西南大學康燕堂/徐立群/徐琨 Adv. Mater.:空心普魯士藍納米框架仿生增強梯度抗菌涂層 2025-07-01
