納米藥物憑借其較好的靶向性在腫瘤的靶向治療中展現出巨大的希望,但是納米藥物在腫瘤部位的滯留時間短的問題仍有待解決。如何對納米載體進行功能化,使其能靈活調控納米粒的尺寸,既能憑借較小的粒徑靶向腫瘤部位,又能在腫瘤部位原位增大粒徑而延長滯留時間是目前亟需解決的一大難題。
針對這一問題,嘉興學院附屬第二醫院陳剛主任、上海交大醫學院附屬瑞金醫院崔文國教授和赫爾辛基大學Helder Santos教授聯合開發了一種光控粒徑可變的納米體系用于提高藥物在骨肉瘤部位的靶向滯留性。通過合成紫外敏感的DOX-NB-PEG作為聚合物載體和化療劑,上轉換顆粒UCNP作為光引發劑,ICG作為光治療劑和成像劑,利用UCNP表面修飾的PLGA與ICG和DOX端的交聯,自組裝形成可通過近紅外光在腫瘤部位原位調控粒徑大小的納米體系。它受到近紅外光激活后能自動脫去表面的PEG,同時內部結構發生聚集,形成粒徑更大的納米顆粒,延長納米藥物在腫瘤部位的滯留時間,實現骨肉瘤的靶向協同治療(圖1)。
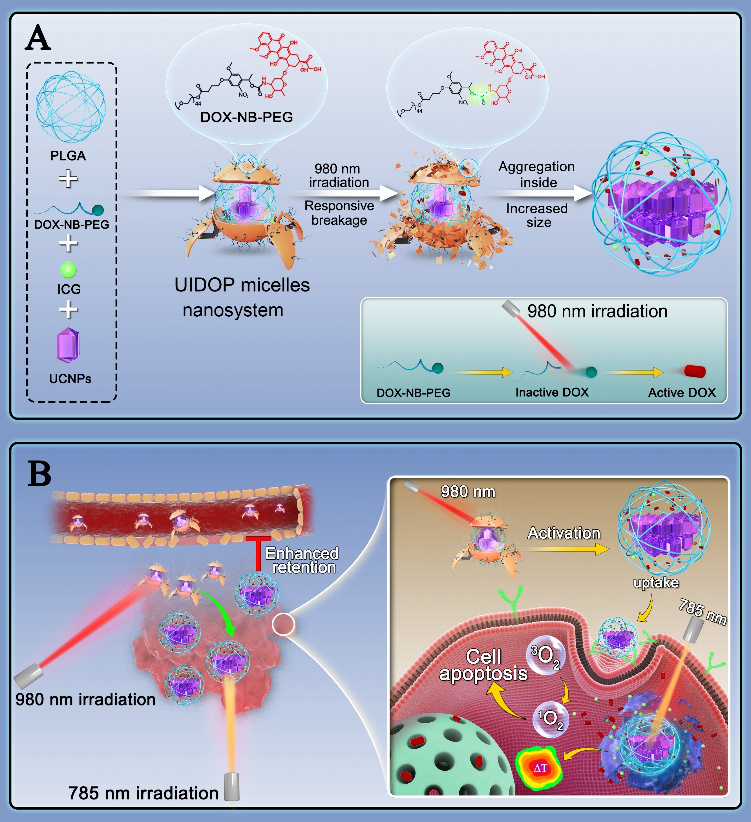
圖1 (A) 光控納米體系的構建以及光控粒徑變化過程;(B)光控納米體系用于腫瘤的協同治療過程
研究表明,經980納米近紅外光激活后,納米體系的內部結構發生了響應性聚集,形成粒徑更大的體系。同時,該納米體系進一步接收到785納米的激光照射后,也能產生良好的光熱和光動力治療的效果(圖2)。

圖2. (A) 上轉換顆粒UCNP;(B) UIDOP micelles;(C) 經980 nm光激活后的UIDOP micelles (D)動態光散射法測粒徑;(E) 化學穩定性;(F) DPBF探針測活性氧;(G) 光熱轉換效率實驗;(H) 光熱效應
研究人員進一步細胞研究發現,UIDOP micelles經980 nm近紅外光激活后,其表面PEG的脫落在一定程度上提高了藥物的細胞攝取量。此外,在受到進一步785 nm光照射后,該體系也能抑制HUVEC細胞成管(圖3)。

圖3 (A) UIDOP micelles的細胞內行為; (B) UIDOP micelles受到光照后抑制HUVEC成管
在小動物成像實驗中,經980 nm光激活后形成的粒徑更大的納米體系在同一時間點時表現出更高的熒光信號值,延長了藥物在腫瘤部位的滯留。熱成像實驗也再次證明該體系在體內所具有的光熱效應(圖4)。

圖4 光控納米體系的相關體內實驗.(A,B)活體成像實驗;(C,D,E)離體組織分布研究;(F,G)熱成像研究
在皮下瘤的小鼠骨肉瘤動物模型中,UIDOP micelles/980/785 irradiation表現出優異的抑制腫瘤效果。相對比于其他組,UIDOP micelles/980/785 irradiation表現出明顯的組織損傷,同時通過免疫組化也發現,腫瘤增殖指標Ki67的表達也大大下降。這個自組裝的納米體系在骨肉瘤靶向協同治療中展現出有效的治療效果,為腫瘤的靶向協同治療提供了一個有效的策略。
以上相關成果發表在Advanced Functional Materials, 2021, 2101262上。該文章第一作者為羅歡歡、孔麗、張峰,通訊作者為陳剛主任、Helder Santos教授、崔文國教授。
論文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202101262
- 中科大王育才/蔣為團隊 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破腫瘤血管基底膜屏障,增強納米藥物瘤內遞送 2025-05-03
- 川大李旭東/陳君澤、港城大譚超良團隊 Adv. Mater.: 多酚-氨基酸縮合物庫用于超高載藥量納米藥物的高通量連續流生產 2025-02-12
- 天工大高輝/李曉暉團隊 Acta Biomater.:二甲雙胍多功能納米藥物克服具核梭桿菌介導的結直腸癌化療耐藥與免疫抑制 2025-02-11
- 天津大學宋東坡教授課題組 Angew:超分子瓶刷自組裝構筑納米到微米跨尺度光學結構 2025-05-15
- 東北林業大學劉守新教授團隊 Small:乙醇介導的膠束自組裝實現具有單晶形態和可調孔結構的有序介孔炭 2025-05-02
- 復旦大學王國偉團隊 Macromolecules:突破自組裝技術新邊界 - 高固含量下嵌段共聚物的熱誘導自組裝與熱誘導協同自組裝 2025-04-27
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
