近期,天津大學仰大勇教授課題組在DNA功能材料可控組裝/解組裝助力精準醫療方面取得新進展,發展了天然多酚介導樹枝狀DNA/細胞膜等生物活性成分動態組裝/解組裝的納米復合體系,豐富了智能響應型DNA材料的設計理念,相關成果發表在Nano Today和Biomaterials,并已申請中國發明專利。天津大學化工學院博士研究生韓金鵬為論文第一作者。研究得到國家自然科學基金等資助支持。
精準醫療理念的提出給人類的疾病治療帶來了革命性變化。設計構建精準藥物遞送體系對精準醫療的發展具有重要理論意義和實用價值。精準藥物遞送是指在空間、時間和劑量上對藥物在體內分布實現全面精準調控,從而提高藥物的利用率,增強治療效果,降低毒副作用。DNA作為天然的生物大分子,具有序列可編程性和序列信息精準傳遞的特點,可根據不同序列設計(即核苷酸單體排序)賦予材料特定結構和生物功能,展現出功能和生物活性可定制的獨特優勢(Chem. Rev. 2020, 120, 9420; Prog. Polym. Sci. 2019, 98, 101163)。近年來,DNA功能材料在核酸藥物遞送領域展現出良好的應用前景。DNA功能材料不僅可以提高核酸藥物穩定性,還能降低藥物免疫毒性。此外,DNA材料可通過序列編程精準響應病變組織或細胞內的特定信號,實現材料的可控組裝/解組裝,滿足精準醫療對材料的特性需求。
近期,仰大勇教授課題組發展了天然多酚介導的樹枝狀DNA動態納米復合體系,提出通過精準調控納米復合物組裝/解組裝,實現核酸藥物高效負載和靶細胞內精準釋放,在提高藥物利用率的同時盡可能地減少毒副作用。在動態復合體系中,樹枝狀DNA與線性DNA連接單元通過堿基互補配對形成三維網絡骨架,與天然多酚單寧酸通過較強的氫鍵作用形成納米復合物。治療性基因DNAzyme和反義寡核苷酸DNA序列分別編碼在樹枝狀DNA和線性DNA結構中;單寧酸作為一種多酚藥物可誘導腫瘤細胞凋亡。為實現納米復合物的精準靶向,腫瘤靶向性適配體S6 DNA通過堿基配對被錨定到納米復合體表面。在腫瘤細胞內,納米復合體系通過可控的程序化解組裝實現了藥物的精準高效釋放:1)在溶酶體微酸性環境中,單寧酸與DNA間的氫鍵作用消失,納米復合體系解離并實現溶酶體逃逸,將單寧酸和樹枝狀DNA釋放到細胞質中;2)在細胞質中,脫氧核糖核酸酶I和過表達的谷胱甘肽進一步觸發樹枝狀DNA解組裝,并特異性地將治療性基因從樹枝狀DNA骨架中釋放出來,發揮基因治療的功效。相關成果發表于Biomaterials, 2021, 273, 120846。
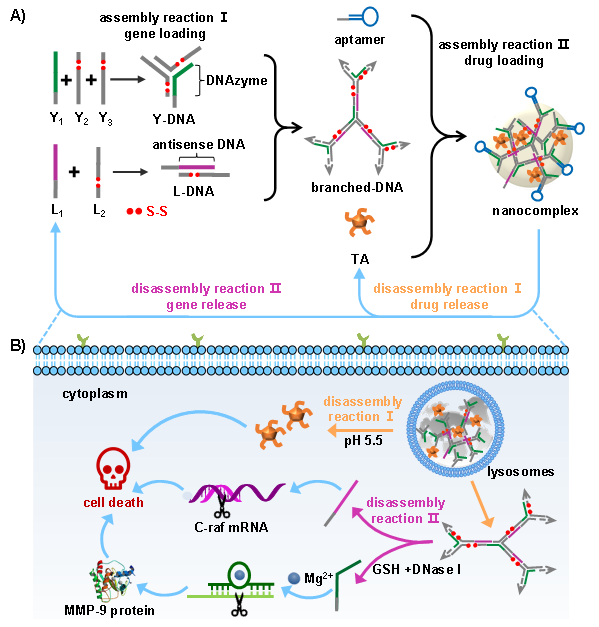
圖1. DNA納米復合體系模塊化組裝路線及其在腫瘤細胞內可控的程序化解組裝過程。A)單寧酸介導樹枝狀DNA納米結構定向組裝實現核酸藥物的高效負載。B)納米復合體系在腫瘤細胞內可控解組裝實現核酸藥物的高效精準釋放。
進一步,仰大勇教授課題組發展了天然多酚藥物介導樹枝狀DNA/RNA和細胞膜共組裝策略,實現了納米復合體系在靶細胞內時空可控的解組裝和基因調控。為實現高效的RNA干擾治療效果,將治療性RNA片段(siPLK)作為連接單元觸發樹枝狀DNA的精準組裝,并在單寧酸的作用下形成納米復合體系。單寧酸與細胞膜表面抗原之間的強親和力,納米復合體系表面的單寧酸分子進一步介導細胞膜的高效組裝,形成細胞膜偽裝的核酸納米復合體系。由于同源腫瘤細胞膜的靶向特異性和體內穩定性,核酸納米復合體系不僅可高效靶向腫瘤部位,而且能顯著延長納米復合體系的體內血液循環時間,并降低免疫系統清除。在腫瘤細胞內,溶酶體酸性微環境和細胞質中核糖核酸酶H(RNase H)會特異性地觸發納米復合體系時空可控的動態解組裝過程,實現優異的化學/基因協同治療效果,單寧酸特異性地誘導腫瘤細胞凋亡,凋亡率高達80%,核酸藥物siPLK特異性抑制致病基因表達,抑制效率高達70%。相關成果發表于Nano Today, 2021, 39, 101160。

圖2. 細胞膜偽裝的核酸納米復合體系精準組裝過程及其靶細胞內響應性解組裝過程。A)單寧酸介導樹枝狀DNA/RNA納米結構和細胞膜共組裝形成細胞膜偽裝的核酸納米復合體系。B)單寧酸對樹枝狀DNA/RNA和細胞膜表面抗原蛋白展現出雙重氫鍵作用力。C)納米復合體系胞內時空可控解組裝,實現基因藥物的精準可控釋放和治療。
天然多酚介導DNA動態組裝充分融合了DNA的精準編程性和天然多酚在動態組裝和生物活性方面的優勢,創制了一種可控的組裝/解組裝新策略,兼顧藥物在載體中的高效負載和靶細胞內精準高效釋放,豐富了智能響應型DNA材料的設計理念。
論文信息:Jinpeng Han, Yuchen Cui, Zi Gu, Dayong Yang*, Controllable assembly/disassembly of polyphenol-DNA nanocomplex for cascade-responsive drug release in cancer cells, Biomaterials, 2021, 273, 120846.

原文鏈接:https://www.sciencedirect.com/science/article/pii/S0142961221002027
論文信息:Jinpeng Han, Yuchen Cui, Feng Li, Zi Gu, Dayong Yang*, Responsive disassembly of nucleic acid nanocomplex in cells for precision medicine, Nano Today, 2021, 39, 101160.

原文鏈接:https://www.sciencedirect.com/science/article/pii/S1748013221000852?dgcid=coauthor
仰大勇教授課題組以生物大分子DNA為研究主線,聚焦DNA生物功能材料智能制造,利用材料化學的手段理解生命系統運行機制,探索重大疾病的診斷治療新途徑。
課題組主頁:http://yanglab-dna.com/
- 蘇州大學李剛教授、美國國家標準與技術研究院Wai Cheong Tam博士 IJBM:牙周組織生物大分子研究進展 2025-05-22
- 蘇大李剛、余嘉/港理大趙澤宇 Int. J. Biol. Macromol.:傷口修復生物大分子材料的研究進展 2024-04-03
- 復旦大學生物大分子課題組 ACS Macro Lett.:再生絲素蛋白“液-液”相分離溶液的剪切固化機制 2023-08-17
- 浙江大學徐志康/張超團隊、呂朝鋒團隊 Adv. Mater.:超重力場作用下的異質取向納米復合水凝膠-“以少勝多”的電磁屏蔽性能 2024-04-19
- 仰大勇教授課題組 Nano Today:細胞內DNA 納米顆粒貫序組裝實現溶酶體干擾和細胞行為調控 2024-03-14
- 天津大學仰大勇團隊 Sci Adv:DNA納米材料可控組裝賦能腫瘤基因治療 2023-09-04
- 北化大尹梅貞教授和蘇志強教授與納米中心陳春英研究員《ANGEW》:“酶促解組裝”的苝酰亞胺基納米簇光敏劑 2020-07-10
