骨腫瘤作為一種常見(jiàn)的腫瘤疾病給患者帶來(lái)了極大的痛苦。實(shí)現(xiàn)骨腫瘤與骨再生的一體化治療是目前面臨的一個(gè)重要的挑戰(zhàn)。近日,西南交通大學(xué)魯雄教授課題組聯(lián)合中國(guó)海洋大學(xué)韓璐教授、廣東省人民醫(yī)院張余教授、華南理工大學(xué)方立明副教授,設(shè)計(jì)了一種可用于促進(jìn)骨組織修復(fù)同時(shí)抑制腫瘤復(fù)發(fā)的一體化治療的支架材料,實(shí)現(xiàn)腫瘤微環(huán)境響應(yīng)性的智能藥物釋放。
該研究以仿貽貝納米MOFs為納米藥物載體,其具有高表面粘附性、良好的水分散性、生物穩(wěn)定性、及腫瘤微環(huán)境敏感性等特點(diǎn),是一種新型的藥物納米遞送系統(tǒng)。首先,基于酚羥基化學(xué),提出多巴胺-金屬離子螯和作用及原位雜化調(diào)控ZIF-8晶體生長(zhǎng)的策略,實(shí)現(xiàn)對(duì)MOF形貌、尺寸及穩(wěn)定性的有效調(diào)控。該仿貽貝納米MOFs(pZIF-8 nanoMOFs)可以作為骨修復(fù)生長(zhǎng)因子(BMP-2)及抗腫瘤小分子藥物(順鉑)釋放載體。該聚多巴胺雜化策略解決了ZIF -8在液體環(huán)境中不穩(wěn)定的問(wèn)題,且賦予其表面大量反應(yīng)活性的酚羥基,為藥物及蛋白固載提供活性位點(diǎn),實(shí)現(xiàn)藥物及蛋白高效穩(wěn)定固載。
其次,將粘附性的載藥pZIF-8 NPs與羥基磷灰石納米顆粒(pHA NPs)交替組裝在3D打印明膠支架表面,通過(guò)控制不同組分組裝次序及層數(shù),使得順鉑與BMP-2在支架中空間有序分布,實(shí)現(xiàn)腫瘤微環(huán)境響應(yīng)的智能按需釋放,腫瘤治療與骨組織修復(fù)在時(shí)間和空間上相匹配,防止術(shù)后骨腫瘤復(fù)發(fā)。
圖1. 具有粘附性的聚多巴胺雜化ZIF-8(pZIF-8 nanoMOFs)和聚多巴胺改性的羥基磷灰石納米顆粒(pHA NPs)在3D打印明膠支架上交替組裝得到具有抗腫瘤和骨修復(fù)雙重功能的3D打印支架。

(a)原位負(fù)載順鉑和BMP-2的pZIF-8 nanoMOFs,及聚多巴胺修飾羥基磷灰石納米顆粒(pHA NPs)制備示意圖。
(b)將載藥pZIF-8 nanoMOFs與pHA NPs采用層自組裝的方式組裝在3D打印明膠支架表面,形成pZIF-8/pHA復(fù)合涂層修飾的明膠(pZIF-8/pHA-G)支架。
(c)pZIF-8/pHA-G支架在植入后,能夠響應(yīng)腫瘤微環(huán)境釋放順鉑從而抑制腫瘤生長(zhǎng);同時(shí),該支架能夠保護(hù)BMP-2的活性,并緩釋BMP-2來(lái)維持有效劑量從而實(shí)現(xiàn)骨缺損修復(fù)。
圖2. 基于貽貝啟發(fā)的酚羥基化學(xué), 采用PDA調(diào)控ZIF-8生長(zhǎng)得到具有良好水分散性、生理穩(wěn)定性、高載藥效率、腫瘤微環(huán)境敏感可控降解性、粘附性的 pZIF-8 nanoMOFs。

(a)PDA 調(diào)控納米尺寸的pZIF-8 MOFs的形成示意圖。
(b)pZIF-8 nanoMOFs和ZIF-8顆粒的TEM圖像。插圖表示pZIF-8 nanoMOFs分散液在激光照射下產(chǎn)生丁道爾效應(yīng),表明其在去離子水中分散均勻。
(c)pZIF-8 nanoMOFs的HAADF-STEM和EDS圖譜。
(d)pZIF-8 nanoMOFs和ZIF-8顆粒的XRD圖譜。
(e)pZIF-8 nanoMOFs和ZIF-8粒子的XPS光譜,以及pZIF-8 nanoMOFs的O1s的高分辨率XPS光譜。
(f)pZIF-8 nanoMOFs和ZIF-8顆粒的Zeta電位。
(g)pZIF-8 nanoMOFs和ZIF-8顆粒在77 K下的氮吸附-解吸等溫線。
(h)模擬腫瘤微環(huán)境下pZIF-8 nanoMOFs的降解行為;(1)pZIF-8 nanoMOFs分散液在不同降解狀態(tài)下的照片,(2)pZIF-8 nanoMOFs在不同緩沖液中的降解曲線。
(i)pZIF-8 nanoMOFs對(duì)順鉑和BMP-2的包封效率。
(j)CLSM顯微照片顯示了pZIF-8 nanoMOFs中封裝的模型蛋白(羅丹明B標(biāo)記的BSA,紅色)的熒光。
(k)照片顯示pZIF-8 nanoMOFs能夠直接在各種基材表面粘附組裝。
圖3. pZIF-8 nanoMOFs和pHA NPs通過(guò)層層自組裝技術(shù)修飾3D打印明膠支架。

(a)照片顯示(i)3D打印明膠支架,(ii)pZIF-8 nanoMOFs和pHA NPs組裝后支架(pZIF-8/pHA-G),該支架具有良好的柔韌性,易于彎曲。
(b)納米顆粒組裝前后的支架表面的SEM圖像及EDS圖像。
(c)SEM分析支架表面的組裝的pZIF-8/pHA復(fù)合涂層的厚度。
(d)pZIF-8/pHA復(fù)合涂層截面的EDS mapping圖像。
(e)基于聚多巴胺輔助pZIF-8 nanoMOFs和pHA NPs 組裝分子機(jī)理圖。
圖4 . 智能藥物釋放系統(tǒng)支架表征。

(a)順鉑和BMP-2在支架表面的空間分布示意圖。
(b)熒光圖像顯示了香豆素標(biāo)記的順鉑(綠色)和羅丹明B標(biāo)記的模型蛋白(BSA,紅色)的在支架表面的分布情況。
(c)在不同緩沖液中順鉑(i)和BMP-2(ii)在pZIF-8/pHA-G支架表面的釋放行為。
(d)SEM圖像顯示,pZIF-8/pHA-G支架在不同緩沖液(i,ii)PBS(pH 7.4)和(iii,iv)含有0.1 mM H2O2的PBS(pH 6.5)中浸泡7天和14天后的表面形貌的變化。
圖5. 體外腫瘤細(xì)胞與支架共培養(yǎng),評(píng)估負(fù)載順鉑的pZIF-8/pHA-G支架對(duì)不同腫瘤細(xì)胞增殖的抑制作用。
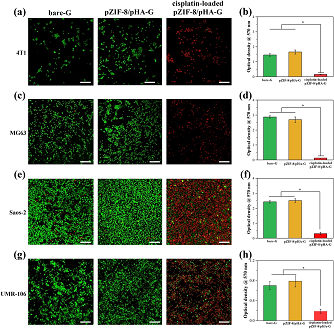
(a)4T1,(c)MG63,(e)Saos-2和(g)UMR-106細(xì)胞在不同支架表面培養(yǎng)3天后的活/死染色圖像。綠色:活細(xì)胞;紅色:死細(xì)胞。
(b,d,f,h)細(xì)胞在支架表面培養(yǎng)3天后,采用MTT測(cè)定不同支架表面的細(xì)胞活性。
圖6 建立小鼠骨肉瘤模型,考察負(fù)載順鉑的pZIF-8/pHA-G支架體內(nèi)抗腫瘤效果。

(a)治療后7天的小鼠體重變化曲線。
(b)治療后7天的相對(duì)腫瘤生長(zhǎng)曲線。
(c)在第7天不同治療組小鼠腫瘤重量分析圖
(d)在第7天帶瘤小鼠的實(shí)物圖像
(e)治療7天后,取樣腫瘤的實(shí)物圖像。
(f)H&E染色,TUNEL染色和Ki67免疫熒光分析經(jīng)不同治療7天后腫瘤組織。S:支架,T:組織。
圖7.負(fù)載BMP-2的pZIF-8/pHA-G支架體外誘導(dǎo)骨髓間充質(zhì)干細(xì)胞(BMSCs)成骨分化。

(a)激光共聚焦圖像顯示培養(yǎng)3天后BMSCs在不同支架上的生長(zhǎng)情況。
(b)SEM圖像顯示BMSCs在pZIF-8/pHA-G支架表面鋪展良好。
(c)在培養(yǎng)3、7天后,MTT法測(cè)定在不同支架表面的BMSCs的增殖情況。
(d)在培養(yǎng)7、14天后,在不同支架表面的BMSCs分泌的堿性磷酸酶(ALP)活性。
(e)在培養(yǎng)7、14天后,RT-PCR測(cè)定不同支架表面的BMSCs的RUNX2的基因表達(dá)。
(f)激光共聚焦圖像顯示培養(yǎng)14天后,不同支架表面的BMSCs的RUNX2熒光標(biāo)記。
圖8. 體內(nèi)股骨缺損模型,研究負(fù)載BMP-2的pZIF-8/pHA-G支架體內(nèi)促進(jìn)骨組織修復(fù)情況。

(a)支架植入兔股骨缺損處的手術(shù)過(guò)程圖。
(b)植入12周后,不同支架治療組的骨愈合率。
(c)植入后12周,不同支架組中骨組織的HE切片染色(c), Masson染色(d)和OCN的免疫組化染色(e)。S:支架,F(xiàn)T:纖維組織,NB:新再生的骨。
該研究成果以“Bioinspired adhesive and tumor microenvironment responsive nanoMOFs assembled 3D-printed scaffold for anti-tumor therapy and bone regeneration”為題在線發(fā)表于《Nano Today》。西南交通大學(xué)姜亞楠博士、華南理工大學(xué)潘西滿碩士、及廣東省人民醫(yī)院姚孟宇博士為論文共同第一作者。該研究得到了國(guó)家重點(diǎn)研發(fā)計(jì)劃、國(guó)家自然科學(xué)基金等項(xiàng)目支持。
原文鏈接:https://doi.org/10.1016/j.nantod.2021.101182
- 浙江大學(xué)吳晶軍、方子正團(tuán)隊(duì) Adv. Mater.:3D打印超強(qiáng)韌可修復(fù)彈性體 2025-07-07
- 南理工/國(guó)科大杭高院王杰平、南理工易文斌等 Nat. Commun.:可消除光固化3D打印層紋的聚二硫代氨基甲酸酯研究 2025-07-03
- 昆士蘭大學(xué)喬瑞瑞團(tuán)隊(duì) Adv. Mater. 綜述:納米復(fù)合材料的創(chuàng)新制備與應(yīng)用 - 從傳統(tǒng)合成到先進(jìn)3D打印技術(shù) 2025-06-25
- 蘇大李剛、附一院李峰和附四院沈罡 IJBM: 兼具抗菌和抗狹窄功能的載藥可降解輸尿管支架 2025-06-29
- 浙江大學(xué)朱利平教授課題組 Adv. Sci.:巧用“分子支架”策略在聚酰亞胺膜內(nèi)構(gòu)筑有機(jī)分子快速傳輸通道 2025-06-01
- 深圳大學(xué)陳仕國(guó)教授團(tuán)隊(duì)《Prog. Mater. Sci.》綜述:周圍神經(jīng)損傷修復(fù)用聚合物支架 2025-05-06
- 西南醫(yī)大口腔醫(yī)院陶剛/黎春暉/蔡蕊團(tuán)隊(duì):具有ROS觸發(fā)藥物釋放特性的可注射水凝膠實(shí)現(xiàn)抗菌劑和抗炎納米顆粒協(xié)同遞送用于牙周炎治療 2025-04-15
