口服藥物遞送具有給藥方便、患者依從性好和安全性高等優勢,是一種具有良好應用前景的抗癌藥物遞送方式。然而,在藥物順利到達腫瘤并發揮療效之前,納米藥物需經一系列胃腸道生理屏障。腸上皮杯狀細胞分泌的黏液是納米藥物口服吸收的重要屏障。一般認為只有表面高度親水的納米藥物才能順利地滲透黏液,如親水性材料聚乙二醇(PEG)常用于載體的修飾,以增加滲透。然而,表面親水性的藥物載體一般對細胞“隱形”,極大地降低了腸上皮細胞的吸收。因此,如何調控納米藥物的表面性質使其具有高效黏液滲透性能的同時,還具有很強的上皮細胞攝取及入血能力,是提高納米藥物的口服生物利用度的關鍵,也是口服抗腫瘤納米藥物設計的難點。
近日,浙江大學申有青教授、邵世群研究員和北京大學李子臣教授在Advanced Materials (IF: 30.849)雜志上發表文章Mucus penetrating and cell-binding polyzwitterionic micelles as potent oral nanomedicine for cancer drug delivery。研究人員開發了一種基于三級胺氮氧結構的口服紫杉醇(PTX)膠束遞送系統,有效實現了膠束的黏液滲透和腸細胞吸收,顯著提高了PTX的口服生物利用度和腫瘤分布,顯著增強了PTX對細胞和肝癌病人來源腫瘤模型的治療效果,為口服抗腫瘤納米藥物設計提供了新思路。
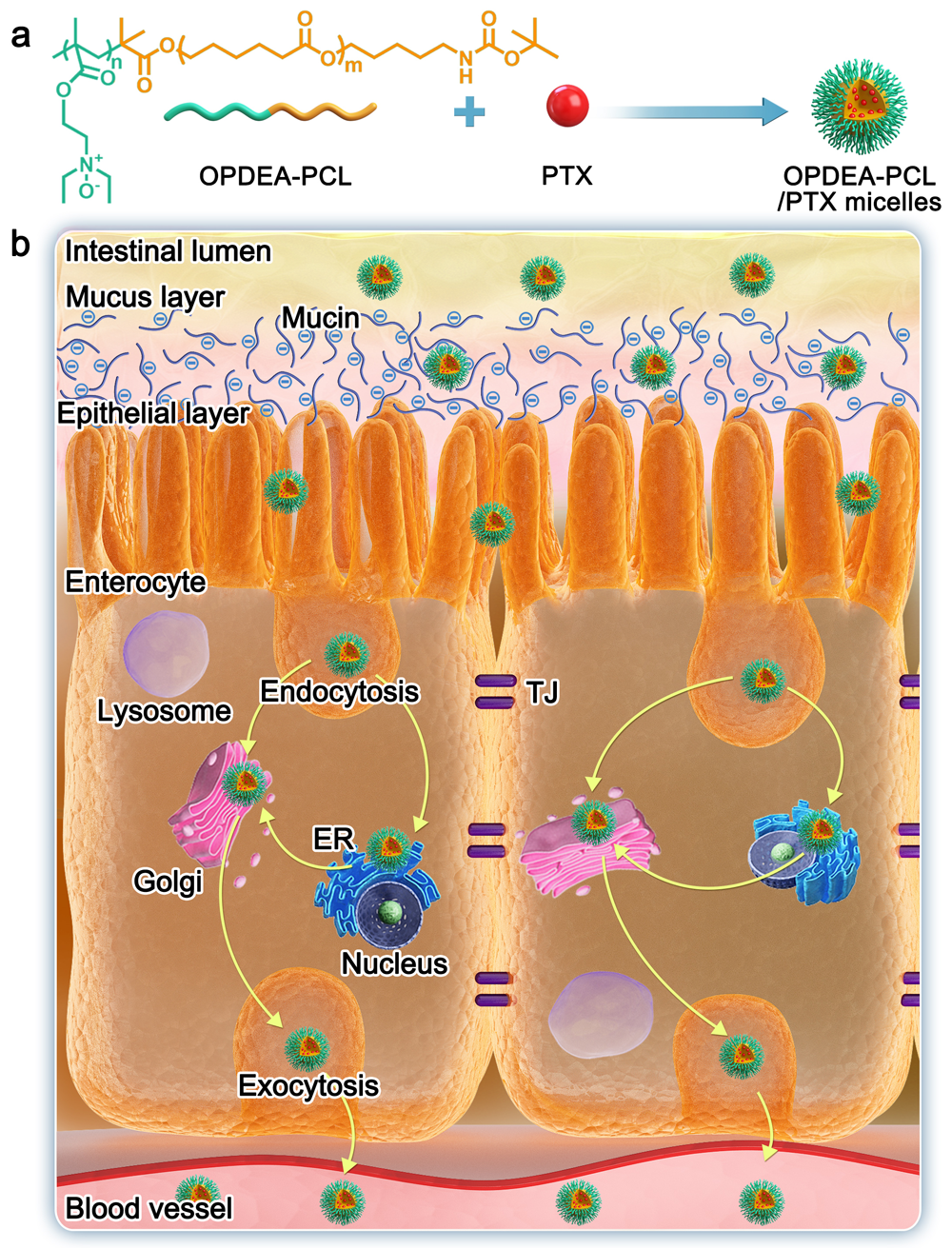
圖1. OPDEA-PCL膠束的黏液滲透和腸細胞吸收示意圖. a, 雙親性嵌段聚合物OPDEA-PCL的化學結構及OPDEA-PCL/PTX膠束的自組裝; b, OPDEA-PCL膠束的黏液滲透和腸細胞的吸收過程.
本文要點:
1)膠束親水端OPDEA為含三級胺氮氧結構的兩性離子聚合物,呈強親水性,與蛋白結合力很弱。研究發現,相比常規的黏液滲透納米粒(PEG-PCL膠束),OPDEA-PCL膠束與粘蛋白的相互作用更弱,具有更強的腸黏液滲透性能。
2)與黏液滲透納米粒對細胞“隱形”不同,OPDEA-PCL膠束能夠與Caco-2細胞膜產生相互作用,觸發非溶酶體依賴的大胞飲介導的細胞內吞。OPDEA-PCL膠束進入細胞后主要分布在內質網和高爾基體,并通過高爾基體/血漿膜、內質網/高爾基體、微管蛋白等途徑進行高水平的轉胞吞作用。
因此,OPDEA-PCL膠束顯著地提高了PTX的口服生物利用度和腫瘤分布。同時,OPDEA-PCL/PTX膠束以跨腫瘤細胞主動滲透形式,獲得了很好的瘤內滲透效果,顯著地抑制了肝癌HepG2模型、人源肝癌腫瘤異種移植模型(PDX)和三陰性乳腺癌模型的生長,且具有良好的體內安全性。

圖2. OPDEA-PCL膠束的黏液滲透和在體腸吸收研究. a, 膠束在黏液Transwell®模型的滲透行為; b,c, 膠束與粘蛋白相互作用的量熱學曲線及相關參數 (b, OPDEA-PCL膠束; c, PEG-PCL膠束); d, 膠束在大鼠空腸灌注3 h后的腸滯留行為及熒光定量; e, 空腸切片的熒光分布.

圖3. OPDEA-PCL膠束在Caco-2細胞單層模型的轉胞吞機制研究. a, 膠束的攝取行為 (左, 共聚焦圖片; 右, 流式細胞分析); b, OPDEA-PCL膠束的內吞機制; c-e, OPDEA-PCL膠束的細胞器分布 (c, 膠束的細胞器分布; b, 劃線區域的熒光分析; e, 膠束與細胞器的共定位系數); f, OPDEA-PCL膠束的細胞外排 (i)及機制 (ii); g, 膠束的細胞轉胞吞研究; h, OPDEA-PCL膠束的細胞轉胞吞機制; i, Transwell®小室基底端4T1細胞攝取經Caco-2細胞轉胞吞OPDEA-PCL膠束的行為 (左, 共聚焦圖片; 右, 流式細胞分析).

圖4. OPDEA-PCL/PTX膠束的抗腫瘤研究. a-c, OPDEA-PCL/PTX膠束抗肝癌HepG2皮下瘤 (a), 肝癌PDX模型 (b)和乳腺癌4T1原位瘤模型 (c)的研究: (i) 腫瘤生長曲線; (ii)腫瘤解剖照片; (iii)平均腫瘤質量; d, 各組腫瘤的H&E和TUNEL分析.
論文通訊作者為浙江大學申有青教授、邵世群研究員和北京大學李子臣教授。第一作者為北京大學博士后范武發。該研究得到國家自然科學基金、國家重點研究計劃和浙江省重點研究計劃項目資助。
原文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202109189
