5月20日,《自然-生物醫(yī)學工程》(Nature Biomedical Engineering)在線發(fā)表華中科技大學生命科學與技術(shù)學院、國家納米藥物工程技術(shù)研究中心楊祥良教授、甘璐教授團隊及同濟醫(yī)學院&中國醫(yī)學科學院基礎醫(yī)學研究所黃波教授合作完成的研究論文“The softness of tumour-cell-derived microparticles regulates their drug-delivery efficiency”。
納米藥物由于具有滲透與滯留增強效應(EPR)、智能響應性、可靶向修飾、不同作用機制藥物共輸運等優(yōu)勢,在腫瘤精準治療和診療一體化方面受到極大關(guān)注。但如何進一步提高抗腫瘤納米藥物的靶向輸送效率和臨床治療效果仍面臨諸多挑戰(zhàn)。
對此,楊祥良教授團隊近年來提出抗腫瘤納米藥物靶向策略的“五得原則”,即跑得動(long circulation)、停得下(targeting)、鉆得深(penetration)、進得去(internalization)和放得出(releasing),并開展了系列研究。大量研究表明,納米載藥系統(tǒng)的納米特征如大小、形貌、表面電荷、表面親疏水性等深刻影響納米藥物的體內(nèi)過程,如血漿蛋白調(diào)理、網(wǎng)狀內(nèi)皮系統(tǒng)吞噬、腫瘤部位富集和出血管、腫瘤組織深部穿透、腫瘤細胞攝取和藥物響應性釋放等,最終對納米藥物的治療效果和安全性產(chǎn)生決定性影響。但是相較于這些納米特性,納米載藥系統(tǒng)的力學性能,如軟硬度、可變形性等對納米藥物的PK、PD行為影響及機制遠未被揭示。
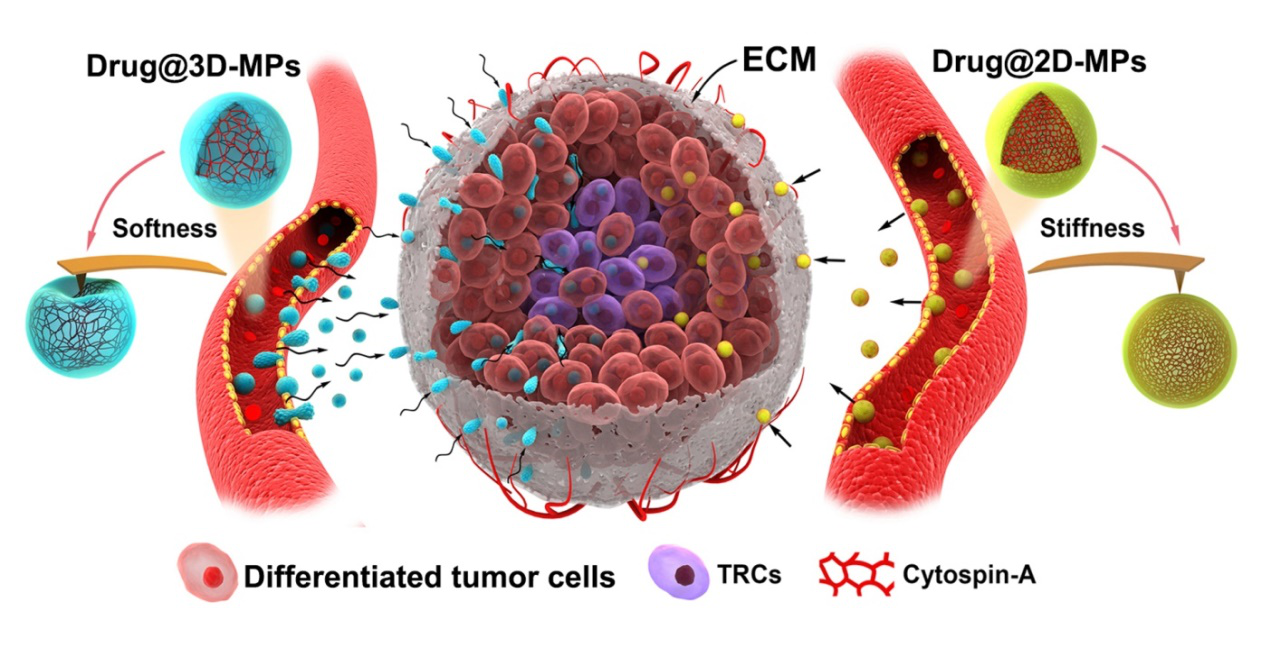
微顆粒(Microparticles, MPs)是細胞受到刺激或者凋亡時釋放的一種100-1000 nm的囊泡結(jié)構(gòu),由于生物相容性高、免疫原性低、靶向性等特點可用做藥物的載體。黃波教授課題組早在2009年在國際上率先對腫瘤細胞來源微顆粒負載抗腫瘤藥物展開研究,證實其具有良好的抗腫瘤效果,并已應用于臨床。本研究利用黃波教授與汪寧教授課題組發(fā)展的軟三維纖維蛋白膠篩選、培養(yǎng)腫瘤再生細胞(tumor-repopulating cells, TRCs)技術(shù),制備了TRCs來源的微顆粒(3D-MPs),與普通腫瘤細胞來源微顆粒(2D-MPs)相比,3D-MPs負載不同抗腫瘤藥物及在多種腫瘤模型上均證實其抗腫瘤作用顯著增強。進一步發(fā)現(xiàn)載藥3D-MPs在腫瘤部位高度富集,且通過多種腫瘤模型(體外3D球模型、皮下瘤模型、腫瘤皮窗模型及斑馬魚腫瘤模型)證實3D-MPs具有更強的穿透腫瘤血管進入腫瘤深部的能力,且更容易被TRCs攝取。利用原子力顯微鏡測定MPs楊氏模量發(fā)現(xiàn),與2D-MPs相比,3D-MPs更加柔軟,更易變形。MPs蛋白質(zhì)組學研究發(fā)現(xiàn)骨架蛋白cytospin-A等參與了MPs的軟硬度調(diào)節(jié)。通過小分子化學藥物或cytospin-A siRNA調(diào)節(jié)MPs的軟硬度證實軟硬度直接影響載藥MPs的體內(nèi)過程及抗腫瘤作用。該研究揭示了納米藥物的力學特性對其PK、PD行為的深刻影響,為發(fā)展抗腫瘤藥物的高效遞送系統(tǒng)提供了新的思路。
Nature Biomedical Engineering是生物醫(yī)學工程領域最頂尖的雜志,華中科技大學生命科學與技術(shù)學院博士生梁清樂、別娜娜及博士后雍土瑩為該論文的共同第一作者。人工智能與自動化學院石曉龍教授、生命科學與技術(shù)學院賈海波教授等參與了該項研究。生命科學與技術(shù)學院汪寧教授和武漢光電國家研究中心張智紅教授等給予了有益的討論和幫助。該研究得到國家重點研究計劃和國家自然科學基金的資助。
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現(xiàn)精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發(fā)現(xiàn)解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準調(diào)控熊果酸螺旋納米纖維原位動態(tài)組裝實現(xiàn)協(xié)同腫瘤增效治療 2025-05-13
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調(diào)的聚乙二醇納米顆粒調(diào)節(jié)納米-生物相互作用,增強靶向藥物遞送 2025-06-12
- 浙大周民教授團隊 Bioact. Mater.:微藻藥物遞送系統(tǒng)"降尿酸-抗炎-消化系統(tǒng)保護"三位一體協(xié)同用于痛風性關(guān)節(jié)炎的治療 2025-06-04
- 蘇大劉莊/楊光保教授團隊招聘博士后 - 材料合成、納米醫(yī)學(腫瘤診療、藥物遞送、免疫治療等) 2025-04-29
- 中科大王育才/蔣為團隊 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破腫瘤血管基底膜屏障,增強納米藥物瘤內(nèi)遞送 2025-05-03
