在脊髓損傷(spinal cord injury, SCI)的病理生理過(guò)程中存在兩個(gè)主要因素導(dǎo)致了神經(jīng)修復(fù)困難,一是損傷急性期的細(xì)胞興奮性毒性環(huán)境導(dǎo)致的繼發(fā)損傷級(jí)聯(lián)反應(yīng),二是損傷中后期的星形膠質(zhì)細(xì)胞過(guò)度激活和增殖導(dǎo)致的膠質(zhì)瘢痕增生構(gòu)成了神經(jīng)再生的屏障。研究顯示,在SCI急性期,壞死細(xì)胞釋放的興奮性氨基酸導(dǎo)致鄰近細(xì)胞的N-甲基-D-天門冬胺酸受體(NMDAR)過(guò)度激活,經(jīng)NMDAR介導(dǎo)的細(xì)胞鈣內(nèi)流增加,導(dǎo)致鈣超載,引起興奮性毒性細(xì)胞死亡,造成周期性傳播的繼發(fā)性損傷。缺氧、細(xì)胞代謝產(chǎn)物和炎性介質(zhì)的蓄積還會(huì)導(dǎo)致局部pH下降,導(dǎo)致局部組織酸中毒。同時(shí),室管膜細(xì)胞的某些亞群在SCI后激活轉(zhuǎn)化為神經(jīng)干細(xì)胞(neural stem cells, NSCs),并進(jìn)一步向膠質(zhì)細(xì)胞分化,形成膠質(zhì)瘢痕。盡管膠質(zhì)瘢痕在SCI早期限制了細(xì)胞毒性分子和炎癥因子的擴(kuò)散,然而在中后期它們成為了軸突再生的屏障。因此,阻斷細(xì)胞繼發(fā)性損傷反應(yīng),同時(shí)對(duì)內(nèi)源性NSCs的分化進(jìn)行調(diào)控是促進(jìn)神經(jīng)修復(fù)的關(guān)鍵。
有研究顯示,鎂離子(Mg2+)可以競(jìng)爭(zhēng)性阻斷 NMDAR 和電壓門控鈣通道,減少細(xì)胞鈣內(nèi)流,從而減少興奮性細(xì)胞死亡。在臨床中,鎂已被廣泛用于多種情況下的神經(jīng)保護(hù),包括子癇、創(chuàng)傷性腦損傷、腦缺血、中風(fēng)和帕金森氏病。然而,血-脊髓屏障的Mg2+轉(zhuǎn)運(yùn)能力有限,經(jīng)靜脈持續(xù)注射高劑量Mg2+僅能使腦脊液中的Mg2+輕度升高。臨床上經(jīng)靜脈應(yīng)用鎂劑治療SCI并未取得一致有效的結(jié)果。因此,通過(guò)植入生物材料在脊髓局部釋放Mg2+以發(fā)揮神經(jīng)保護(hù)作用可能是一個(gè)更有效的策略。
基于以上背景,蘇州大學(xué)骨科研究所賽吉拉夫課題組、李斌課題組合作制備了介孔MgO顆粒并負(fù)載神經(jīng)形態(tài)發(fā)生素Purmorphamine(PUR)和Retinoic acid(RA),然后與聚(L-丙交酯-co-ε-己內(nèi)酯)(PLCL)通過(guò)靜電紡絲技術(shù)制備了定向纖維支架以修復(fù)脊髓損傷(圖1)。實(shí)驗(yàn)成果以《Magnesium Oxide/Poly (L‐lactide‐co‐ε‐caprolactone) Scaffolds Loaded with Neural Morphogens Promote Spinal Cord Repair through Targeting the Calcium Influx and Neuronal Differentiation of Neural Stem Cells》為題發(fā)表在《Advance Healthcare Materials》上。
研究者在評(píng)估了不同配比的MgO/PLCL支架的微觀形貌、力學(xué)性能、親水性、Mg2+釋放特征和細(xì)胞粘附性能后,選擇MgO:PLCL = 25:100配比的纖維支架進(jìn)行后續(xù)試驗(yàn)。
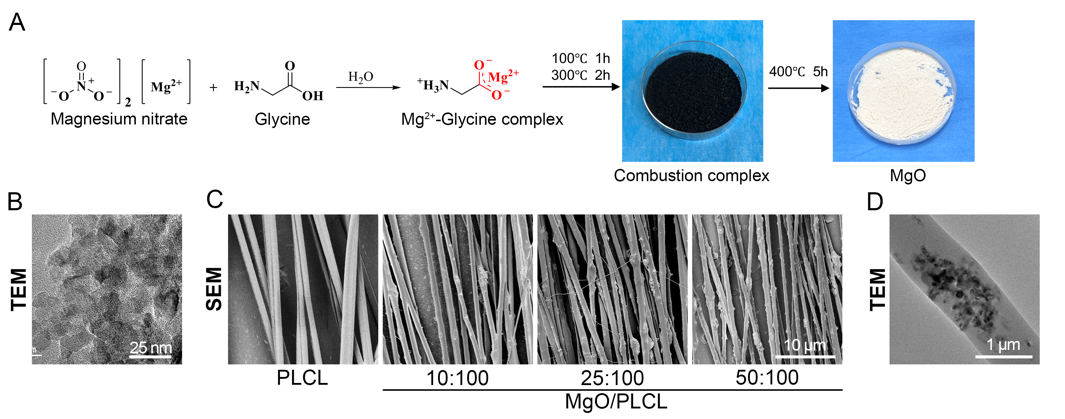
圖 1 介孔MgO的合成與不同配比MgO/PLCL纖維的制備。
研究者在體外模擬了脊髓損傷后的酸性環(huán)境和興奮性毒性環(huán)境,發(fā)現(xiàn)MgO/PLCL支架這兩種條件下均能保護(hù)神經(jīng)細(xì)胞的存活(圖2,圖3)。另外,負(fù)載PUR/RA的MgO/PLCL支架顯著促進(jìn)了NSCs向神經(jīng)元方向的分化,減少了膠質(zhì)細(xì)胞的形成(圖4)。同時(shí),對(duì)神經(jīng)元軸突形態(tài)的進(jìn)一步分析顯示,負(fù)載PUR/RA的MgO/PLCL支架顯著促進(jìn)了軸突的生長(zhǎng)。

圖 2 MgO/PLCL支架的細(xì)胞粘附性能以及在酸性環(huán)境中對(duì)神經(jīng)細(xì)胞的保護(hù)作用。

圖 3 MgO/PLCL支架減少了NMDA誘導(dǎo)的神經(jīng)元鈣內(nèi)流和神經(jīng)元凋亡。
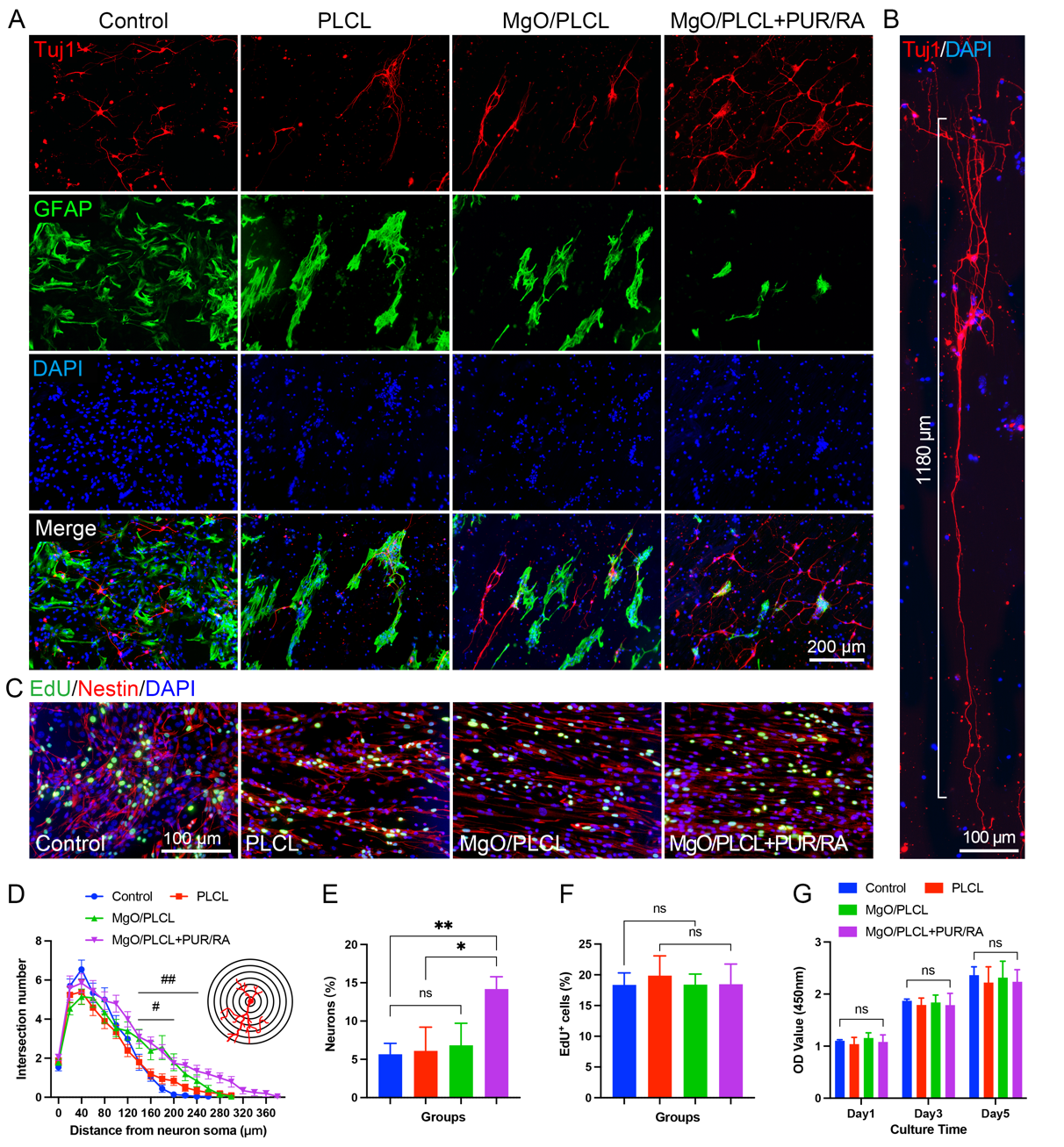
研究者進(jìn)一步構(gòu)建了小鼠脊髓T9半切損傷模型,并植入支架。結(jié)果顯示,2周后各組的脊髓內(nèi)源性NSCs均可見(jiàn)激活,而MgO/PLCL+PUR/RA組的脊髓中央管中可見(jiàn)大量Nestin+細(xì)胞并與支架形成細(xì)胞通路,清晰地顯示了Nestin+ NSCs 通過(guò)脊髓中央管向纖維支架的遷移。同時(shí),MgO/PLCL+PUR/RA組損傷周圍的凋亡細(xì)胞顯著減少,存活細(xì)胞增多(圖5)。在支架植入8周后,MgO/PLCL+PUR/RA支架顯著減少了損傷區(qū)域的星形膠質(zhì)細(xì)胞(GFAP標(biāo)記)的激活,并促進(jìn)了大量神經(jīng)元的形成(圖6)。

圖 5 MgO/PLCL+PUR/RA支架在體內(nèi)促進(jìn)內(nèi)源性NSCs激活和遷移,減少細(xì)胞凋亡。

該研究從SCI的病理生理機(jī)制出發(fā),通過(guò)復(fù)合材料同時(shí)干預(yù)了SCI后的繼發(fā)性損傷級(jí)聯(lián)反應(yīng)和膠質(zhì)瘢痕增生。據(jù)悉,這是含鎂生物材料植入修復(fù)SCI的首次研究。蘇州大學(xué)骨科研究所賽吉拉夫和李斌教授為本文通訊作者,謝計(jì)樂(lè)和李家穎博士生為本文第一作者。
