南丹麥大學吳昌柱教授團隊《Nat. Commun.》:基于大腸桿菌化學修飾而成的人工孢子實現高效的界面生物催化
自然界中,生物體為了抵御環境中的不利因素,進化出了各自的防御機制。這其中,細菌孢子可以抵御多種環境壓力,包括紫外光照射及化學試劑毒害,顯示了其在生物合成領域的潛力。但自然的孢子多處于休眠狀態,且其中的酶活性較低。為了解決這些問題,研究人員開發了人工孢子,即以保護性材料將細菌包裹于其中,保護細菌與酶的活性,有效提高生物催化效率,并拓展其在不對稱合成及生物燃料制造等領域的應用。目前的人工孢子構建主要基于天然細菌及其本身自帶的酶,這便大大限制了其在生物催化領域的應用范圍。而相比之下,大腸桿菌作為最通用的重組酶表達平臺,則沒有在人工孢子化方面取得較大的進展。
在此背景下,吳昌柱教授及其博士后孫志永(目前就職于浙江工業大學)受自然界中細菌孢子可以抵御多種環境壓力(紫外光照射及化學試劑毒害)的啟發,利用聚多巴胺的良好生物相容性及保護性,包裹大腸桿菌的表面構建人工孢子。該孢子體系可以有效抵御紫外光、高溫、有機溶劑、有機-水兩相界面張力的影響,維護細菌的代謝活性。同時,其內部可以表達多種酶,并應用于單酶及多酶的界面催化過程(圖1)。此外,該孢子可以負載化學催化劑,并成功構建起化學-酶偶聯催化體系,進一步豐富了細胞工廠的應用。相關工作近日以“Artificially Sporulated Escherichia coli Cells as a Robust Cell Factory for Interfacial Biocatalysis”為標題發表于《Nature Communications》。

圖1. 包裹大腸桿菌構建人工孢子應用于界面生物催化的示意圖。
人工孢子的表征
他們首先利用透射電鏡(TEM)和掃描電鏡(SEM)對人工孢子進行了直觀的表征,并以原始的大腸桿菌作為對照。在TEM圖像中,可以看到細胞外的包覆層(圖2e,2f),而原始細菌外則沒有。SEM表征中,可以直觀看到顆粒狀的包裹物和粗糙的表面(2g),而原始細菌的表面相對光滑。綜合SEM和TEM,人工孢子的形成得到了有力的證實。
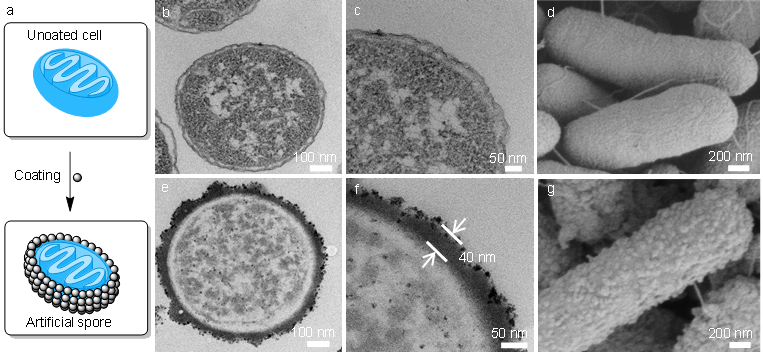
圖2. 人工孢子的表征。b-d:原始細菌。e-g:人工孢子。
生物相容性表征
之后,他們對包裹過程的生物相容性進行了驗證。在細菌活/死實驗中,通過與原始細菌對比(圖3a),可以看到人工孢子有著較高的存活率(圖3b,綠色)。此外,人工孢子的繁殖能力也與原始細菌相當(圖3c)。

圖3.生物相容性評價。a: 原始細菌。b:人工孢子。c:生長曲線。
保護性
為了研究人工孢子對各種環境壓力的抵御能力,他們分別施加紫外光、溫度、有機溶劑以及有機-水兩相界面張力等外界壓力。在細菌的死/活實驗以及酶活穩定性實驗中,人工孢子的表現均大大優于原始細菌(圖4)。例如,在紫外光照射下,原始細菌幾乎全部失去活性,而人工孢子則有超過85%的存活率(圖4b,4c)。此外,人工孢子中的酶活性也幾乎是原始細菌的2倍(圖4d)。在其他壓力環境下,人工孢子也有著相似的存活率和酶活性。
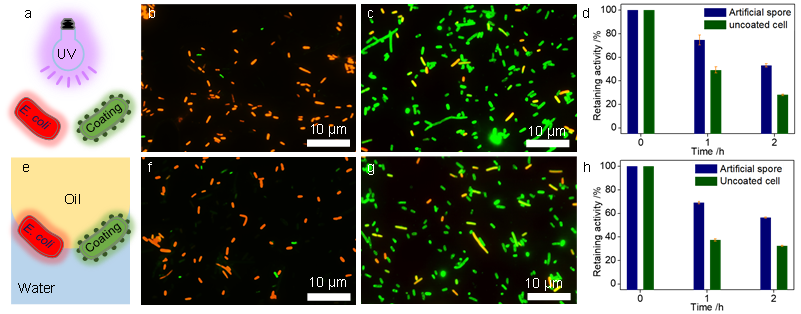
圖4.保護性評價。a-d: 原始細菌和人工孢子在紫外光照射下存活率以及酶活性。e-h: 原始細菌和人工孢子在兩相界面處存活率以及酶活性。
乳液表征
此后,他們通過對包裹材料組分的優化,成功構建了人工孢子穩定的皮克林乳液體系。利用兩種不同的染料分別標記有機相與水相,證實他們得到了水包油型乳液(圖5d)。此外,通過表達綠色熒光蛋白于細胞內,可以看到人工孢子分布于有機-水兩相的界面上(圖5f, 5g),該發現也通過SEM得到了直觀的證實(圖5h)。

圖5.基于人工孢子的乳液的研究。
單步界面生物催化反應研究
他們首先表達酯酶CalB于大腸桿菌中,隨后進行表面包裹,構建人工孢子。通過優化人工孢子表面親疏水性、乳液體系的有機相-水相比例及人工孢子用量,該乳液體系的催化效率遠高于其他兩組對照試驗(圖6c)。此外,該人工孢子在重復多次利用的情況下,仍保持著較好的活性與催化效率(圖6d)。由于大腸桿菌是一種廣泛適用的酶表達平臺,他們又在其他兩種酶體系中進行了界面催化的拓展,同樣顯示出遠遠優于對照試驗的結果(圖6f,6h)。值得注意的是,由于人工孢子始終保持著代謝活性,使其在涉及輔酶再生的反應中,可以依靠自身的代謝路徑完成輔酶再生而無需其他輔助。這將大大降低反應體系的復雜性和催化過程的成本,顯示了該體系獨特的應用優勢。
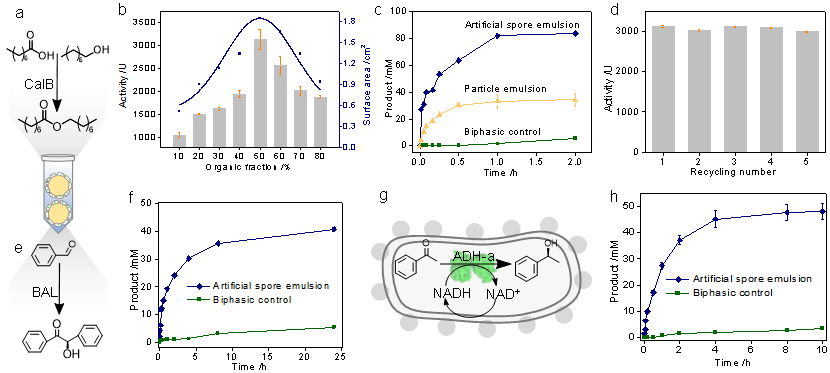
圖6.單步酶催化反應的研究。a-d:基于脂肪酶CalB的乳液體系優化、對比及重復利用。e-f:酶BAL的界面催化研究。g-h:酶ADH-a的界面催化的研究。
多酶界面生物催化的研究
在單酶反應證實過可行性后,他們進一步將反應體系拓展到多酶催化。為此,他們以2種多酶耦聯催化反應為研究對象,如圖7所示,證明了在界面催化體系中的反應效率都遠高于對照實驗。

圖7.多酶催化反應的研究。a-b:基于ADH-ht和CalB的多酶界面催化。c-d: 基于ADH-ht和BAL的多酶界面催化。
化學-酶耦聯界面生物催化的研究
隨后,他們進一步以人工孢子為載體,負載了金屬催化劑鈀,并通過TEM進行了鈀納米顆粒的分布表征(圖8b,8c)。值得注意的是,金屬催化劑的負載并沒有影響人工孢子的繁殖能力(圖8d)和乳化能力(圖8f)。此外,他們設計了化學-酶偶聯催化體系(圖8g),并進一步證明了界面催化體系的優越性(圖8h)。

圖8.化學-酶耦聯催化反應的研究。a-d:負載鈀納米顆粒的人工孢子表征及其生長曲線。e-h: 負載鈀納米顆粒的人工孢子的乳液研究及其界面化學-酶耦聯催化研究。
他們利用生物相容性的聚多巴胺包裹大腸桿菌,構建了可以抵御環境壓力的人工孢子,并通過在其內部表達多種不同的酶,使其作為細胞工廠應用于單酶、多酶以及化學-酶耦聯的界面生物催化過程。鑒于該細胞工廠的通用性以及化學催化劑的多樣性,可以展望,以人工孢子為基礎構建的界面催化體系將為二者的結合提供更多的可能性,并有望應用于解決合成工業上的難題。文章第一作者為孫志永博士,通訊作者為吳昌柱教授,通訊單位為南丹麥大學。
原文鏈接:https://www.nature.com/articles/s41467-022-30915-2
課題組介紹:
南丹麥大學化學系的吳昌柱教授課題組致力于酶催化及綠色化學的研究; 其研究重點是通過對酶及細胞的化學修飾獲得new-to-nature的生物催化應用。詳情請參見:https://www.wugroup.sdu.dk/
希望對該組研究方向感興趣的研究人員與他們取得聯系。該課題組現在資金充足、年輕、有活力,具有較好的發展前景;目前招聘多個全獎的博士和博士后位置;丹麥的博士生、博士后的質量和待遇享譽全球。
孫志永博士目前就職于浙江工業大學生物工程學院,任獨立PI。課題組長期招募有機合成、生物催化或自組裝等研究背景的青年教師及博士后,歡迎有興趣的研究人員與他們聯系。詳見:http://www.homepage.zjut.edu.cn/szy/cbb/
更多關于該工作的細節,請參考原文 DOI:10.1038/s41467-022-30915-2








