基于嵌段共聚物膠束納米蝕刻技術( block copolymer micelle nanolithography, BCMN),作者成功制備了納米間距梯度變化的金點陣列。選擇內皮細胞、平滑肌細胞作為代表性細胞,發現梯度變化的 RGD 納米間距對內皮細胞的取向和遷移的引導效果并不明顯,但是可以顯著誘導平滑肌細胞的取向,并且使得平滑肌細胞向較小 RGD 納米間距的區域定向遷移。兩種細胞對梯度變化的 RGD 納米間距的響應差異為將來的細胞篩選、促傷口愈合的細胞選擇性材料的表面修飾提供了新的思路。


圖1 梯度納米圖案的設計和制備 (A) BCMN法制備了梯度納米圖案材料流程示意圖;(B) 基底各位置納米間距的統計結果
復旦大學丁建東團隊設計的梯度納米陣列夾在兩個均勻的納米陣列當中,這樣可以更好地控制整個圖案。他們制備了三種圖案,各自在兩側具有不同的納米間距的范圍,如圖1所示;同時,中間短的梯度相仿,均約為每毫米20 nm或者每50微米1 nm。通過在納米圖案表面培養人臍靜脈內皮細胞(HUVEC或EC)和人動脈平滑肌細胞(HASMC或SMC),發現細胞在某些條件在可以感知到這種納米尺度下的微小的梯度變化。
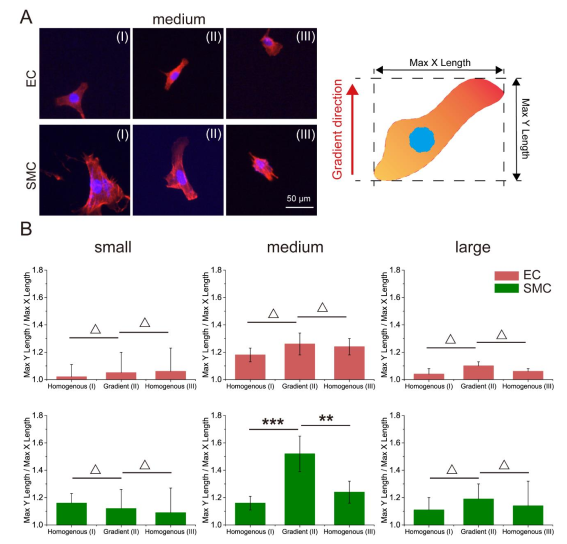
圖2 RGD納米間距誘導細胞取向 (A) HUVEC和HASMC在中梯度納米圖案上的熒光圖像;(B)分別計算HUVEC和HASMC的Max Y Length / Max X Length,分析細胞取向
作者統計了兩類細胞在梯度納米區域中遷移時在各個時刻x、 y 方向上的平均位移。對于內皮細胞和平滑肌細胞,在中等RGD 納米間距起始范圍的梯度納米圖案對兩類細胞的定向遷移產生了選擇性。

根據課題組之前的研究, 70nm 是一個臨界納米間距。一旦 RGD 納米間距大于這個數值,特異性細胞黏附顯著減弱。由此作者推測:當 RGD 納米間距的梯度變化跨越 70 nm 時,細胞對其自身前后端的納米間距變化將最為敏感。其中medium 組別跨越了70 nm ,黏附面積的劇烈變化帶來的黏附能力差異很有可是造成細胞在這個跨度下發生明顯細胞取向與定向遷移的原因。然而,對于內皮細胞,在跨 70 nm 的梯度變化下,黏附面積的變化沒有平滑肌細胞顯著(在梯度變化的兩側,平滑肌細胞黏附面積下降到了小間距部分的 47.1%,而內皮細胞只下降到 60.6%) ,這也可能是其細胞取向與定向遷移相較于平滑肌細胞不明顯的原因所在。

材料表面的活性配體RGD 納米間距的梯度可以選擇性地調控細胞的取向和遷移。這一發現給新一代生物材料的設計帶來一定的啟示。
作者團隊簡介:
論文以復旦大學何俊豪碩士生為第一作者,其導師丁建東教授為通訊作者。丁建東教授為復旦大學高分子科學系教授、聚合物分子工程國家重點實驗室主任。其課題組主要從事生物醫用材料研究,包括細胞與材料相互作用的基本科學問題、組織再生材料和先進醫療器械、藥物緩釋載體以及醫美材料的基礎研究和臨床轉化。
原文鏈接:
Junhao He, Runjia Shen, Qiong Liu, Shuang Zheng, Xinlei Wang, Jingming Gao, Qunsong Wang, Jiale Huang, and Jiandong Ding*, RGD nanoarrays with nanospacing gradient selectively induce orientation and directed migration of endothelial and smooth muscle cells.ACS Appl. Mater. Interfaces
https://pubs.acs.org/doi/10.1021/acsami.2c10006
- 華東理工劉潤輝教授課題組《Adv. Mater.》:多肽模擬聚合物實現內皮細胞選擇性功能 2022-09-02
- 上海交大傅德皓教授團隊 ACS Nano: 仿生納米囊泡逆轉骨髓內皮細胞分泌表型治療骨質疏松癥 2022-07-13
- 四川大學王云兵教授團隊Biomaterials:仿生內皮細胞功能涂層用于促進血管愈合 2022-04-01
