青島大學叢海林/胡浩團隊《Carbohyd. Polym.》:殼聚糖衍生物交聯水凝膠 - 控制釋放多聚脫氧核苷酸用于傷口治療
2022-11-20 來源:高分子科技
核酸作為一種生物活性物質,可直接作用于致病的靶基因或mRNA,在基因水平發揮作用,具有特異性高、效率高、作用時間長等明顯優勢。基因治療已被廣泛研究用于多種疾病,如癌癥、病毒感染、遺傳性疾病等的治療。在創面修復應用中,由于損傷部位周圍功能細胞和生長因子表達的紊亂,基因遞送顯示出了可行性。但由于核酸的易降解性,在傷口治療中缺乏有效的給藥途徑,設計智能水凝膠實現核酸的時空可控輸送,對臨床應用具有重要意義。

圖1. 復合水凝膠的制備及應用示意圖
為了提高MoS2的生物相容性和聚合物溶液的均一性,作者首先對其作了SCS改性。作者確定了NIPAAm與SCS的混合比例以平衡共聚物的低臨界溶解溫度(LCST)與水凝膠的力學性能的關系。如圖2所示,水凝膠的宏觀狀態隨溫度變化。水凝膠的儲存模量(G’)遠大于損耗模量(G”),驗證了水凝膠的彈性狀態。SEM表征了水凝膠典型的三維網絡結構,能量色散光譜也表明了水凝膠組分的均勻性。干燥的凝膠在吸收PDRN溶液后變得柔軟和流動。作者使用注射裝置驗證了水凝膠的可注射性和流動性。此外,水凝膠還能很好地黏附在手指關節表面。

圖2. 水凝膠的物理性能表征
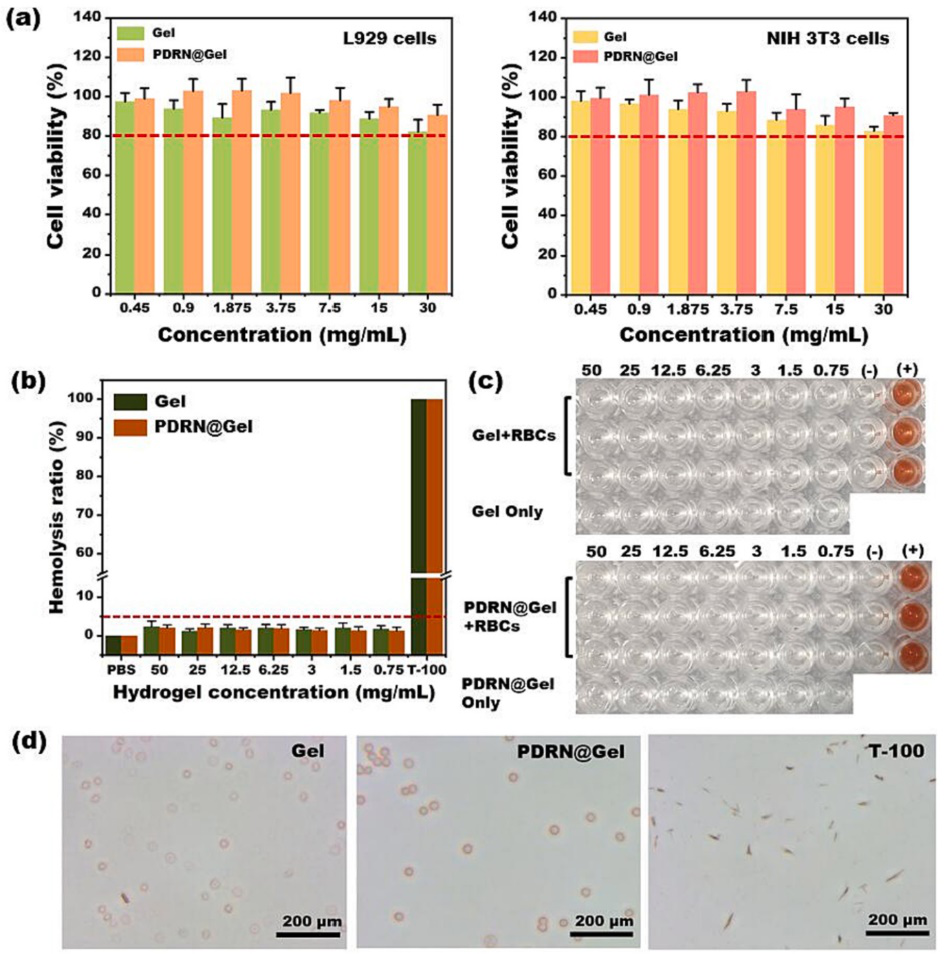
圖3. 水凝膠的生物相容性表征
隨后,作者利用弗朗茨擴散池(Franz)模擬了水凝膠在創面的真實藥物釋放行為(圖4)。結果顯示,在近紅外照射下,水凝膠中的MoS2迅速實現光熱轉換,促使凝膠網絡快速釋放PDRN。作者隨后又探究了照射時間與藥物釋放之間的關系,并確定了最佳輻照時間,以保證合適的藥物釋放。
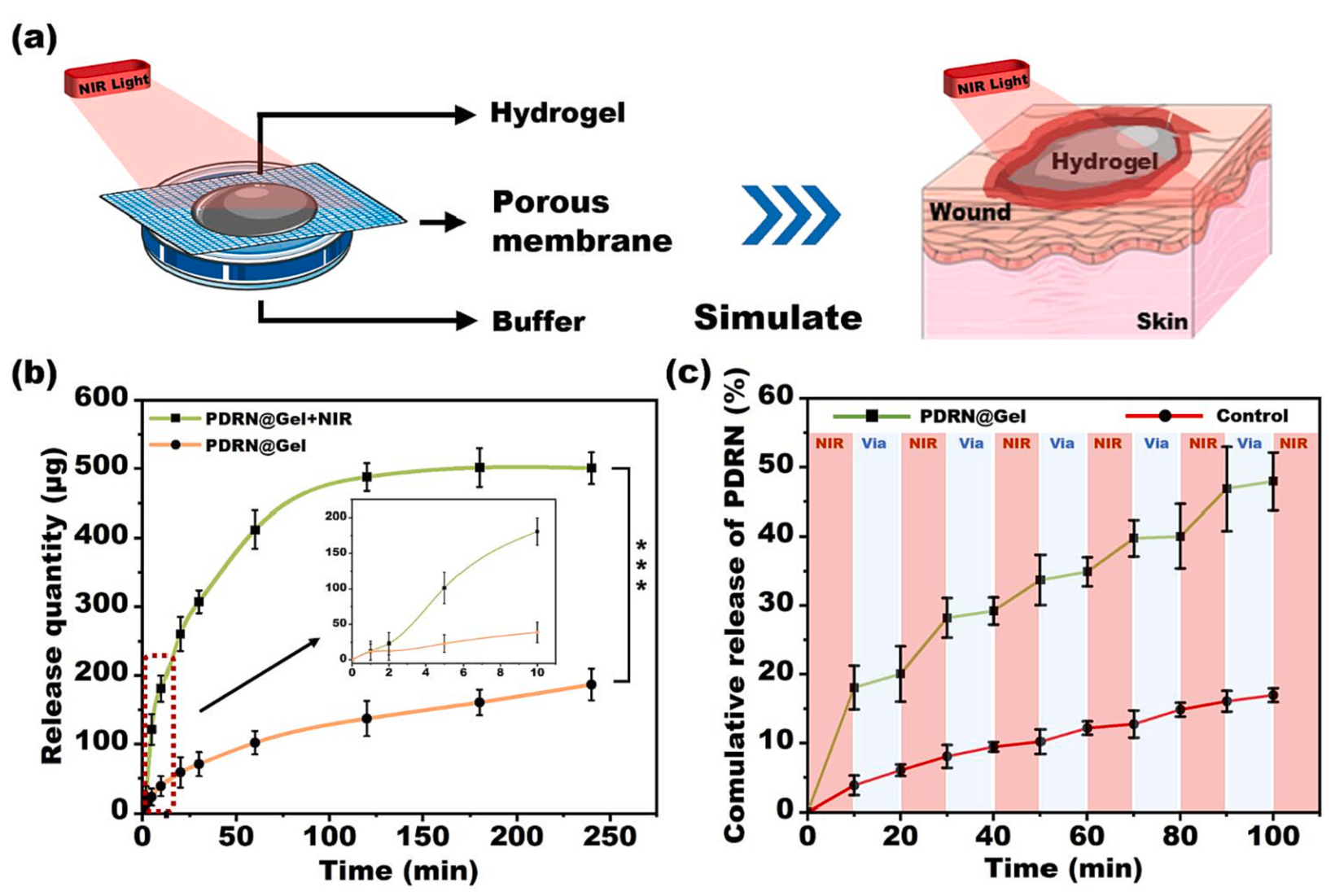
圖4. 水凝膠的藥物控制釋放探究
加速的細胞增殖和遷移有利于傷口的快速修復。如圖5所示,作者驗證了在體外近紅外光的作用下,水凝膠對細胞增殖和遷移的促進效果,證明了該復合水凝膠作為傷口敷料用于核酸類藥物控釋的有效性。

圖5. 水凝膠的促細胞增殖和遷移測試
如圖6所示,作者使用小鼠全層皮膚創面模型評價了水凝膠的治療效果,聯合治療組的小鼠表現出更快的傷口愈合。第2天創面收縮率超過20%,明顯高于其他組。作者還表征了創面愈合過程中傷口部位細胞因子的變化,結果顯示水凝膠能夠加快創面部位血管形成并具有抗炎作用。在組織學分析中,實驗組的創面表現出了高質量的創面愈合效果。
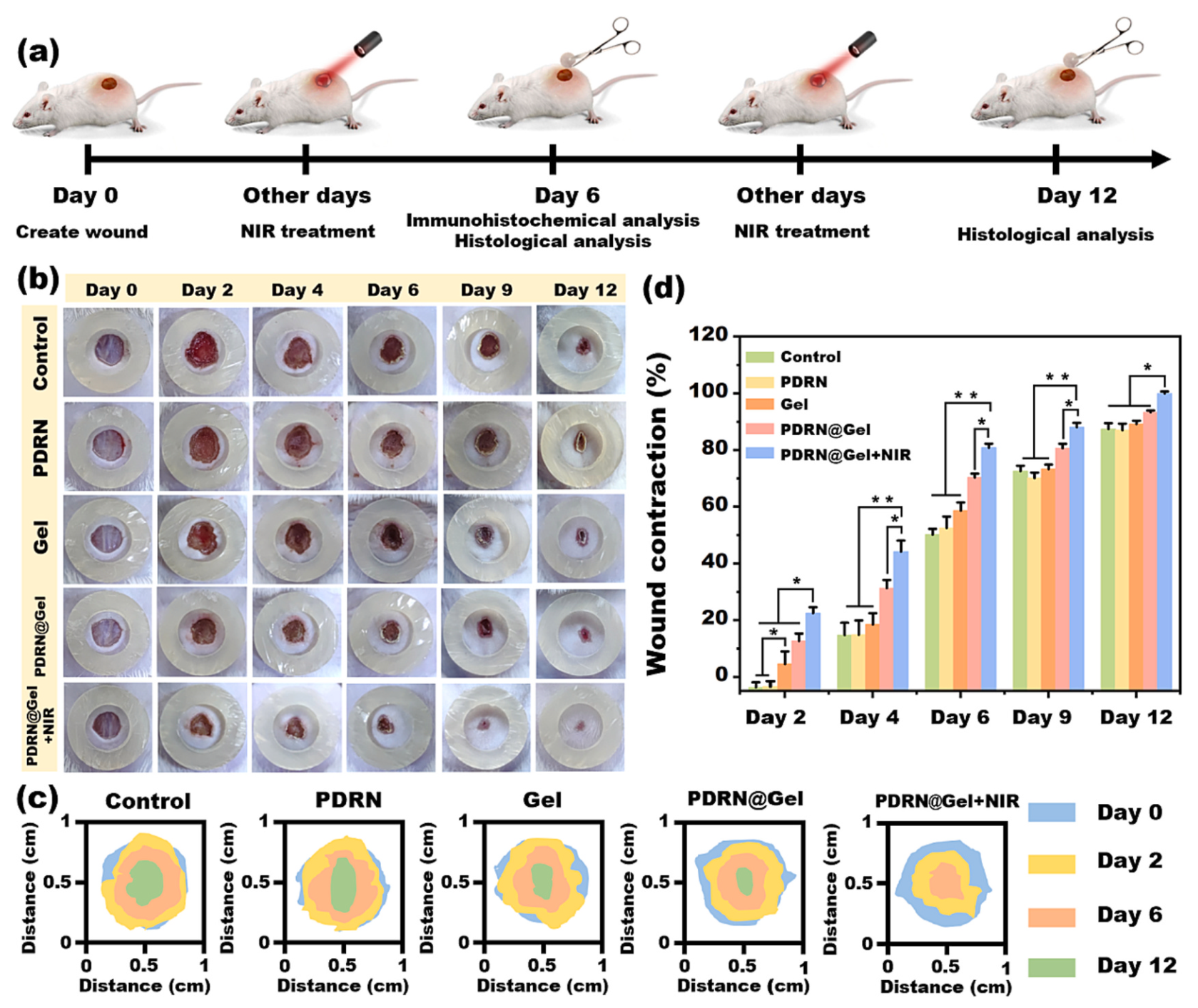
圖6. 小鼠全層皮膚創面模型評價水凝膠的治療效果
總體而言,作者制備了一種納米復合水凝膠,在近紅外光的遠程刺激下,可實現PDRN的“時空可控”釋放,打破了以核酸為基礎的藥物在皮膚管理中容易降解和難以遞送的困境。納米復合水凝膠具有使用方便、黏附性好、抗菌性能增強等優點,提高了創面愈合效率,促進了皮膚缺損修復過程中的毛囊、皮膚附屬器、膠原蛋白以及細胞因子等的增加。作者提出的水凝膠模型為基因治療在創面治療中的應用提供了解決方案。
原文鏈接:https://doi.org/10.1016/j.carbpol.2022.120298
版權與免責聲明:中國聚合物網原創文章。刊物或媒體如需轉載,請聯系郵箱:info@polymer.cn,并請注明出處。
(責任編輯:xu)
相關新聞
- 上海市第一人民醫院馬小軍/東華大學何創龍 Bioact. Mater.:TME響應復合水凝膠靶向抑制MYC驅動型骨肉瘤生長與轉移 2025-01-17
- 西電王忠良教授團隊 Adv. Sci.:焦亡之光 - 突破乳腺癌術后復發的新希望 2024-11-13
- 西北大學范代娣教授團隊 Adv. Sci.:用于傷口狀態實時監測和綜合治療的納米復合水凝膠 2024-09-18
- 中山大學腫瘤醫院楊江教授 JCR:可吸入式pH響應型電荷反轉聚合物-siRNA復合物用于ALK融合陽性肺癌靶向基因治療 2025-03-31
- 天津大學仰大勇團隊 Sci Adv:DNA納米材料可控組裝賦能腫瘤基因治療 2023-09-04
- 國家納米科學中心孟幻團隊《Nano Today》:納米白介素-10基因免疫治療促進肌肉修復 2022-07-25
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
