由于椎間盤(pán)退變(IVDD)引起的下腰背疼痛已成為發(fā)病率最高的疼痛性疾病之一,給社會(huì)經(jīng)濟(jì)造成沉重的負(fù)擔(dān)。作為椎間盤(pán)(IVD)的重要結(jié)構(gòu),髓核組織(NP)與纖維環(huán)(AF)和軟骨終板(CEP)一起維持著脊柱的穩(wěn)定性和生理功能。髓核細(xì)胞密度降低、基質(zhì)金屬蛋白酶等相關(guān)降解因子的過(guò)度表達(dá)是IVDD的主要表現(xiàn),也是細(xì)胞外基質(zhì)中II型膠原(COL II)和糖胺聚糖(ACAN)的密度下降進(jìn)而無(wú)法維持椎間盤(pán)正常生理功能的原因。當(dāng)前臨床治療所使用的物理治療、脊柱融合術(shù)或椎間盤(pán)切除術(shù)雖然取得一定的效果,但是并不能實(shí)現(xiàn)髓核組織再生,從根本上逆轉(zhuǎn)IVDD。通過(guò)合適的組織工程材料向退變髓核組織遞送髓核細(xì)胞或干細(xì)胞是提高髓核組織細(xì)胞密度,恢復(fù)細(xì)胞外基質(zhì)合成的直接手段,近年來(lái)也被廣泛研究。然而,遞送過(guò)程中細(xì)胞泄露導(dǎo)致的異位成骨、體外擴(kuò)增培養(yǎng)髓核細(xì)胞存在去分化的風(fēng)險(xiǎn)、干細(xì)胞的活性和分化能力會(huì)在遞送后受到損害等問(wèn)題在一定程度上限制了該方法的應(yīng)用。研究表明存在于健康和退行性 IVD 中的干/祖細(xì)胞具有分化成髓核組織的潛能,是替代外源性細(xì)胞的理想細(xì)胞源。募集和促進(jìn)這些細(xì)胞向髓核分化需要多種生物活性因子時(shí)序性參與,但目前仍缺乏既滿足合適的活性因子釋放動(dòng)力學(xué),又滿足有效募集細(xì)胞、促進(jìn)細(xì)胞生長(zhǎng)浸潤(rùn)和向髓核分化的支架材料。
針對(duì)以上問(wèn)題,華南理工大學(xué)國(guó)家人體組織功能重建工程技術(shù)研究中心曹曉東教授團(tuán)隊(duì)報(bào)道了一種順序釋放生物活性因子的可注射微孔性微凝膠組裝體支架MA-TNS(圖1),它能夠促進(jìn)細(xì)胞的浸潤(rùn)和長(zhǎng)入,并通過(guò)快速釋放基質(zhì)細(xì)胞衍生因子-1a(SDF-1α)募集內(nèi)源性干細(xì)胞,隨后持續(xù)釋放轉(zhuǎn)化生長(zhǎng)因子-β1(TGF-b1)促進(jìn)干細(xì)胞向髓核分化,最終實(shí)現(xiàn)大鼠退變髓核再生和抑制食蟹猴腰椎間盤(pán)的進(jìn)一步退變。該工作以“Injectable and Microporous Microgel Assembly with Sequential Bioactive Factor Release for the Endogenous Repair of Nucleus Pulposus”為題發(fā)表在國(guó)際權(quán)威期刊Advanced Functional Materials上(Adv. Funct. Mater. 2024, 2315592)上,曹曉東教授和博士后馮琦為該文的通訊作者,華南理工大學(xué)博士研究生羅惠彤為文章第一作者。
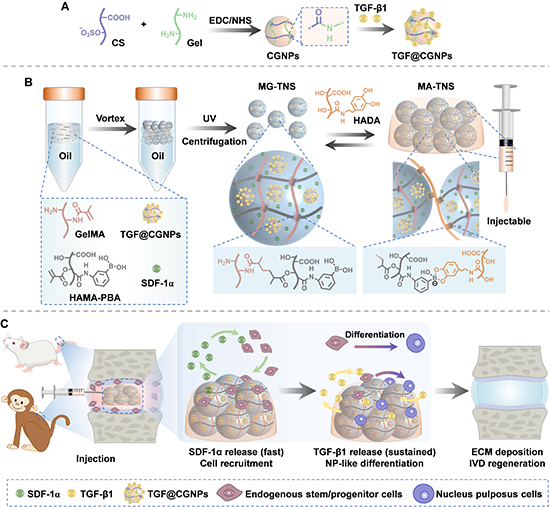
圖1 順序釋放生物活性因子的可注射微凝膠組裝體的制備及髓核修復(fù)示意圖
為了實(shí)現(xiàn)SDF-1α和TGF-b1的順序釋放,研究團(tuán)隊(duì)首先制備硫酸軟骨素/明膠復(fù)合納米顆粒(CGNPs)負(fù)載生長(zhǎng)因子TGF-β1,獲得納米粒子TGF@CGNPs(圖1A)。隨后,TGF@CGNPs和趨化因子SDF-1α共同封裝到微凝膠中。該雙活性因子負(fù)載的微凝膠(MG-TNS)以雙鍵修飾的明膠(GelMA)以及雙鍵和苯硼酸雙修飾的透明質(zhì)酸(HAMA-PBA)為基體材料,通過(guò)乳液法和光交聯(lián)的方式獲得(圖1B)。微凝膠通過(guò)表面上的苯硼酸基團(tuán)和作為組裝劑的多巴胺修飾的透明質(zhì)酸(HADA)發(fā)生苯硼酸酯鍵,形成具有連通微孔的微凝膠組裝體支架(MA-TNS)。
納米顆粒通過(guò)去溶劑化法獲得,并以靜電相互作用將TGF-b1負(fù)載于納米顆粒上。TGF@CGNPs平均粒徑為193.7 nm(圖2)。
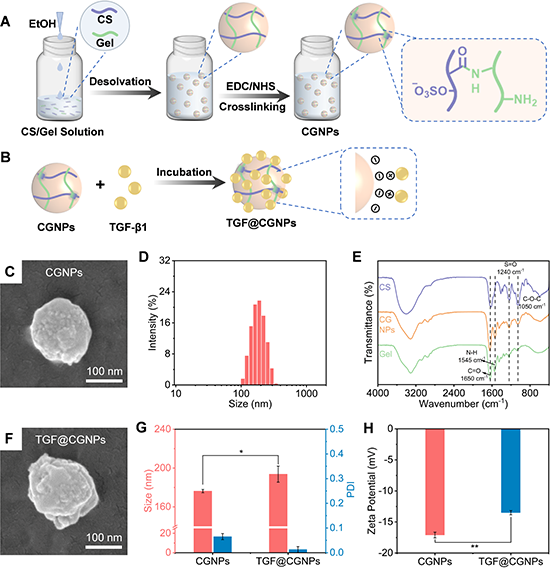
圖2 負(fù)載TGF-β1的納米顆粒的制備和表征
乳液法制備獲得的雙活性因子負(fù)載微凝膠平均粒徑為132.6±20.9 μm,SDF-1α和TGF@CGNPs可均勻分散在微凝膠中(圖3)。經(jīng)苯硼酸酯反應(yīng)獲得的微凝膠組裝體MA-TNS具有連通的微孔結(jié)構(gòu)。在椎間盤(pán)自然載荷頻率范圍內(nèi)(25-35 rad s-1)保持穩(wěn)定的凝膠狀特性。MA-TNS還具有良好的可注射、自愈合特性,能滿足髓核修復(fù)的基本需求。此外,在活性因子釋放方面,該組裝體可實(shí)現(xiàn)SDF-1α在前期快速釋放(7天后累積釋放量為62.4%),TGF-β1隨后持續(xù)性釋放(28天累積釋放量為46.5%),這有利于快速募集細(xì)胞和長(zhǎng)期誘導(dǎo)細(xì)胞分化和促進(jìn)細(xì)胞外基質(zhì)沉積。
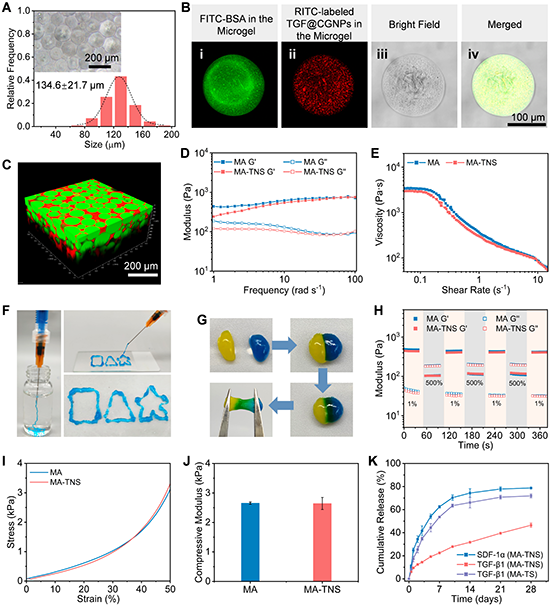
圖3 順序釋放生物活性因子的微凝膠組裝體MA-TNS的制備及理化性能表征
MA-TNS通過(guò)釋放趨化因子具有良好的募集干細(xì)胞的能力。微凝膠組裝體具有良好的細(xì)胞相容性,能夠支持干細(xì)胞增殖。隨著培養(yǎng)時(shí)間的延長(zhǎng),細(xì)胞生長(zhǎng)進(jìn)入微凝膠組裝體內(nèi)部,5天長(zhǎng)入深度約為300 μm,且封裝在微凝膠組裝體中的生物活性因子對(duì)浸潤(rùn)深度沒(méi)有顯著影響。相比之下,相同組分制備的塊狀水凝膠會(huì)明顯阻礙細(xì)胞浸潤(rùn)行為,細(xì)胞長(zhǎng)入深度不隨培養(yǎng)時(shí)間變化。這些發(fā)現(xiàn)表明具有連通微孔結(jié)構(gòu)的微凝膠組裝體有利于細(xì)胞浸潤(rùn)(圖4)。
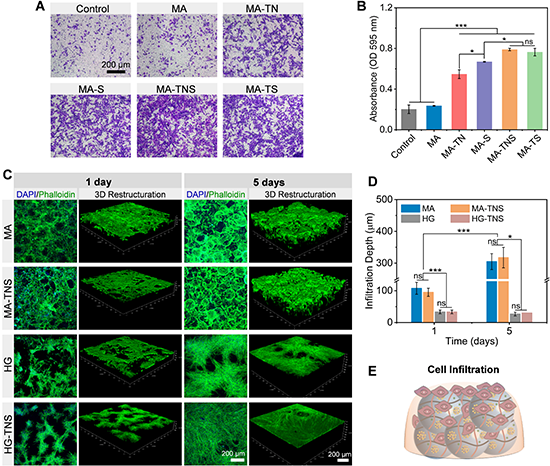
圖4 微凝膠組裝體募集干細(xì)胞以及促進(jìn)細(xì)胞浸潤(rùn)長(zhǎng)入的能力表征
在體外分化實(shí)驗(yàn)中(圖5),培養(yǎng)7天和21天后,與其余組相比,含有TGF-β1的組中軟骨標(biāo)志性基SOX9、ACAN和COL II的表達(dá)水平明顯上調(diào),且這種上調(diào)效果隨時(shí)間推移而增強(qiáng)。免疫熒光染色進(jìn)一步表明,微凝膠組裝體釋放的TGF-β1顯著促進(jìn)了ACAN和COL II的表達(dá)。與TGF-β1和SDF-1α同時(shí)從組裝體中快速釋放的組別(MA-TS)相比,在納米顆粒的幫助下,TGF-β1從微凝膠組裝體(MATNS)中持續(xù)釋放,能夠在細(xì)胞培養(yǎng)過(guò)程中保持生物活性和有效濃度,使軟骨標(biāo)志性基因和蛋白高表達(dá)。因此,微凝膠組裝體MA-TNS能夠確保內(nèi)源干細(xì)胞長(zhǎng)期有效分化。
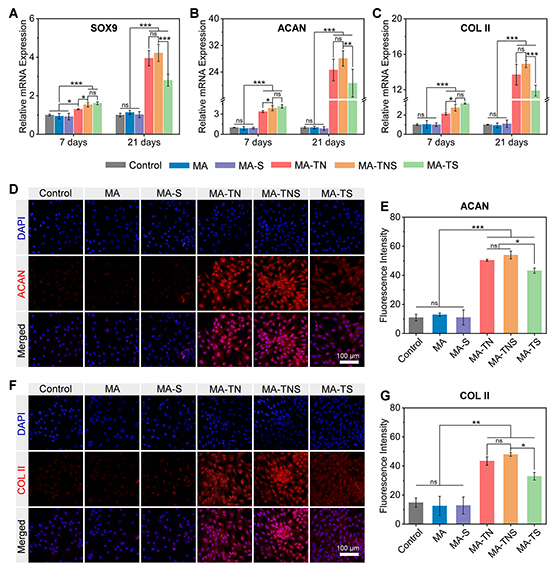
圖5 順序釋放生物活性因子的微凝膠組裝體體外誘導(dǎo)干細(xì)胞分化能力表征
為了評(píng)價(jià) MA-TNS 在體內(nèi)的治療效果,研究團(tuán)隊(duì)采用針刺法在大鼠尾椎建立IVDD模型,并注射材料,并于術(shù)后5周和10周進(jìn)行影像學(xué)和組織學(xué)分析(圖6)。與其他實(shí)驗(yàn)組相比,髓核組織能維持較高的水合狀態(tài),結(jié)構(gòu)較完整,組織界限清晰。免疫組化表明MA-TNS組髓核組織中COL II和ACAN含量明顯較多(圖7),說(shuō)明雙活性因子順序釋放微凝膠組裝體能夠顯著改善髓核細(xì)胞外基質(zhì)代謝平衡,實(shí)現(xiàn)髓核再生。
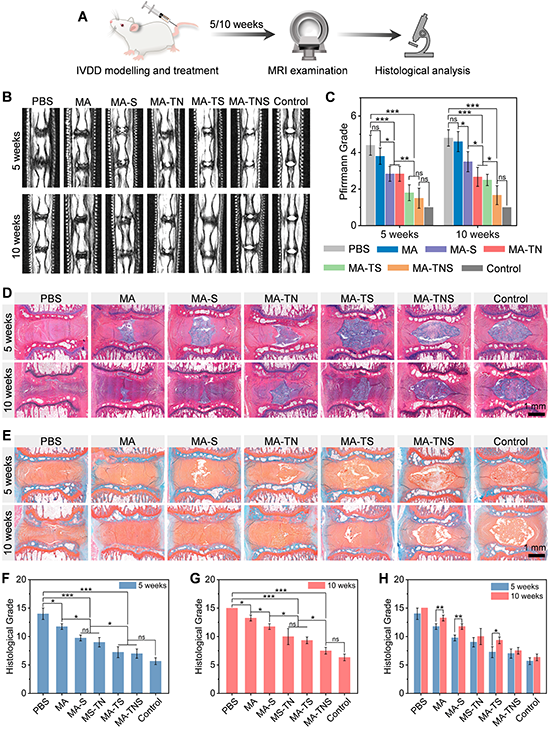
圖6 微凝膠組裝體修復(fù)大鼠尾椎效果表征
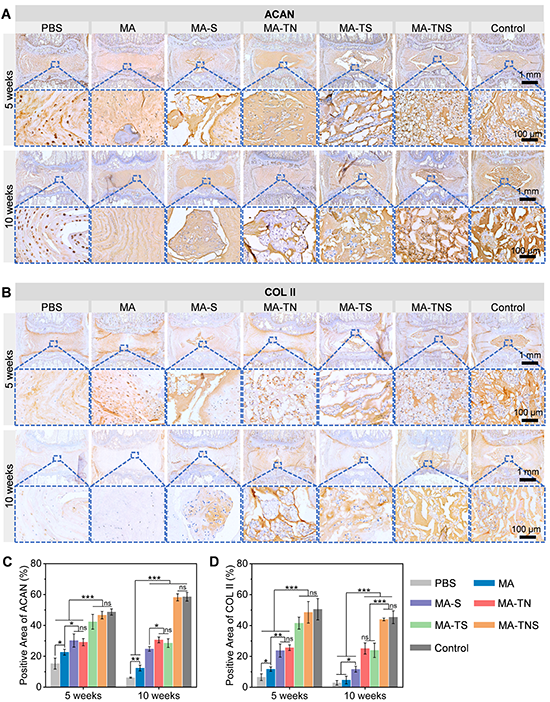
圖7 微凝膠組裝體修復(fù)大鼠尾椎免疫組化表征
與大鼠等小型嚙齒類(lèi)動(dòng)物相比,食蟹猴的椎間盤(pán)在生物學(xué)和生物力學(xué)方面與人類(lèi)椎間盤(pán)更為相近。研究團(tuán)隊(duì)進(jìn)一步評(píng)估了材料體系對(duì)食蟹猴腰椎間盤(pán)退變的療效(圖7)。術(shù)后6周和25周結(jié)果表明MA-TNS這一雙活性因子順序釋放微凝膠組裝體能夠抑制食蟹猴椎間盤(pán)進(jìn)一步退變。本研究為組織工程退變椎間盤(pán)的功能再生提供了新思路,有望進(jìn)一步應(yīng)用于椎間盤(pán)退變的臨床治療中。
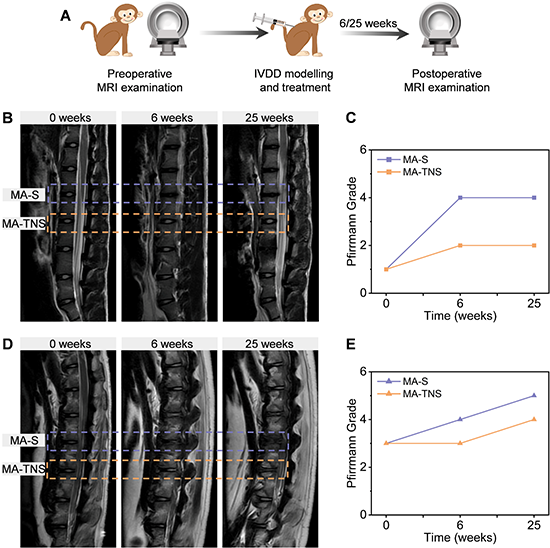
圖8 微凝膠組裝體治療食蟹猴腰椎間盤(pán)退變
該研究工作得到國(guó)家自然科學(xué)基金委面上項(xiàng)目(52073103、 52272276、51873069和52203164)以及聯(lián)合基金項(xiàng)目(U22A20162)等經(jīng)費(fèi)資助。
原文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202315592








