蛋白質藥物因具有精確的結合作用和較弱的脫靶效應而極具應用前景。然而,蛋白藥物存在體內穩定性差、半衰期短等問題。比如在急性缺血性卒中溶栓治療過程中,溶栓蛋白的循環時間較短會降低了溶栓效率,而提高劑量又會增加全身性出血風險。構建蛋白聚集結構是調控蛋白生物活性、體內循環時間和生物分布的重要方法。其中,探索合成具有中空結構的納米或亞微米尺度蛋白組裝體對于蛋白藥物的仿生結構設計、納米生物微反應器制備和藥物遞送系統研發等均有重要的科學和實際意義。目前,蛋白中空組裝結構或蛋白囊泡的主要制備方法有蛋白組裝法、兩親性高分子修飾蛋白自組裝法和乳液界面凝聚法等,但在具有分級結構蛋白囊泡的制備方面仍存在一定挑戰性。
日前,中國科學院大學屈小中教授課題組發展了一種基于功能蛋白與兩親聚合物膠束間相互作用的動態模板法,制備出可原位封裝治療物質的高分子交聯蛋白囊泡。研究人員通過將苯并咪唑修飾在線性聚乙二醇(PEG)的端基上,使其在水溶液中形成聚合物膠束,其表面分布的苯并咪唑基團可與b-環糊精(b-CD)修飾的溶栓蛋白尿激酶(uPA)通過主-客體相互作用連接,從而改變界面穩定性并促使PEG鏈向膠束表面遷移結合更多蛋白分子,最終形成具有中空結構的蛋白殼層,即高分子交聯uPA囊泡。在此過程中,預先將治療物質(如超氧化物歧化酶SOD)負載于膠束模板中即可形成空腔中包載SOD的uPA@SOD囊泡。該團隊進而與北京大學第一醫院的合作者一起對囊泡進行了性能表征,發現uPA@SOD具有更長的體內循環時間,有利于其在腦組織微血管中的分布,因而在治療大腦中動脈栓塞動物模型時,可以有效溶解微循環血栓并進行神經保護治療,顯著提高了后期窗口(> 4.5 h)溶栓和橋接治療的效率(Chem. Eng. J. 2023, 455, 140705)。

圖1. 動態模板聯合分步組裝法制備多層次結構高分子-蛋白納米組裝體示意圖。
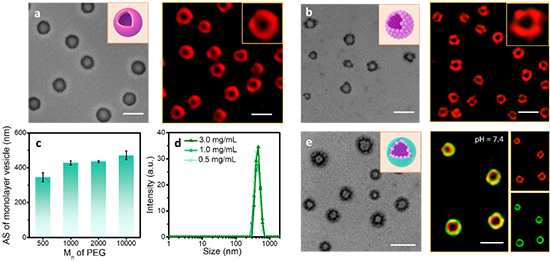

圖3. 具有三層結構的球形蛋白囊泡、環狀蛋白組裝體、Janus蛋白囊泡和棒狀多級組裝體。
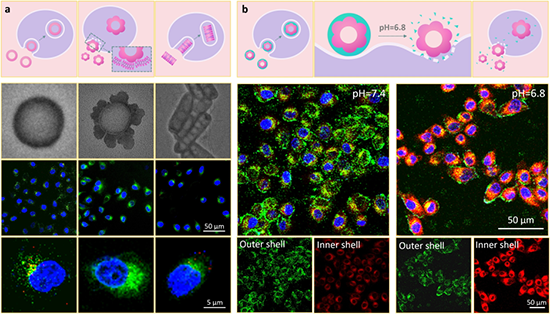
圖4. 高分子-蛋白納米組裝體細胞內化的形貌依賴性。
原文鏈接:Ren, Y.; Guan, S.; Qu, X. Polymer-protein assemblies with tunable vesicular and hierarchical nanostructures.Angew. Chem. Int. Ed. 2024, 63, e202317251.
https://doi.org/10.1002/ange.202317251
- 塔夫茨大學David L. Kaplan和哈佛醫學院Y. Shrike Zhang教授《PNAS》:高彈性功能蛋白質材料的設計 2022-02-03
- 美國科學家將果蠅蛋白與功能蛋白編織成天然纖維 2011-04-22
- 中國海大何治宇/于良民 Adv. Sci.:基于傳統中藥冰片的聚合物膠束腦內藥物遞送系統-用于精確適應病理機制的缺血性腦卒中治療 2025-01-21
- 復旦大學占昌友教授團隊《Nano Today》:親和誘捕法實現生物介質中PEG化聚合物膠束的高效分離-破譯聚合物膠束的體內命運 2024-04-25
- 西工大邵東燕、孔杰等 AHM:基于IL-15共激活的聚合物膠束構建及其在NK細胞免疫治療中作用機制研究 2023-11-23
