口服降糖藥作為2型糖尿病(T2DM)臨床管理的一線方案,憑借其用藥便捷、治療成本低和無創給藥等核心優勢,在超過60%患者的血糖調控中發揮關鍵作用。然而,現有口服降糖制劑普遍存在藥代動力學特征不理想的問題,以磺脲類藥物(如格列本脲)為代表的口服降糖藥,因其非線性吸收特性和代謝個體差異,易引發劑量相關性低血糖事件,帶來嚴重的治療安全隱患。因此,優化口服降糖藥的藥代動力學特性以降低低血糖風險,對提升糖尿病治療安全性和患者生活質量具有重要臨床價值,仍是當前藥物研發領域的難點之一。
近期,南京林業大學森林食物資源挖掘與利用全國重點實驗室黃超伯教授和中國科學院寧波材料所海洋關鍵材料全國重點實驗室陳濤研究員,受單細胞藻類螺形扁藻(Phacus helicoides)螺旋啟發,開發了一種基于微流控技術的內部螺旋球體(HSs)制備策略(圖1)。該研究通過設計新型微流控裝置,實現了Fe?O?納米顆粒在球體內部的螺旋分布,賦予HSs在外部磁場調控下同步自旋與圓周運動的協同驅動能力并實現高效混合;進一步負載葡萄糖氧化酶(GOD)與格列本脲(GLIB)后,HSs兼具吸附、催化葡萄糖氧化及pH響應釋放藥物的三重功能。在2型糖尿病大鼠模型中,HSs治療后餐后2小時血糖水平從峰值降至正常水平,且低血糖事件發生率由傳統給藥方式的14.2-18.6%顯著降低至3.8%,改善了磺脲類藥物劑量相關性低血糖風險難題。
2025年6月16日,相關成果以“Bioinspired Heterogeneous Spheres with Tunable Helical Structure for Accurate and Efficient Control of Sugar Blood Level”為題,發表在Advanced Materials上(Adv. Mater. 2025, 2504878. DOI: 10.1002/adma.202504878)
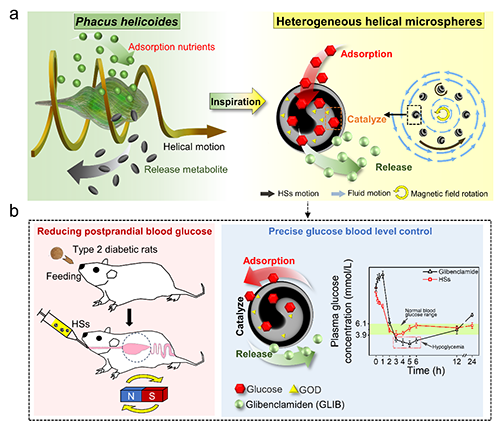
圖1 螺旋藻啟發的具有可調內部螺旋結構的異質球體,用于準確有效地控制血糖水平
研究團隊通過自制的模塊化水凝膠球體制備裝置(圖2a)生成螺旋球體(HSs),該裝置包含流體供應模塊(可調流速)、微通道模塊(可調角度與直徑)、液滴生成模塊(可調高度)及球體成型模塊(可調CaCl2濃度與轉速)。將含的海藻酸鈉(SA)溶液與含Fe3O4納米顆粒的SA溶液分別泵入微通道,兩股非牛頓流體因扭矩力作用形成Fe3O4螺旋分布的液滴(圖2b);隨后液滴落入接收浴中與Ca2+交聯固化成球,最終獲得內部納米顆粒呈螺旋排列的HSs(圖2c)。此外,可以通過調整各個模塊的制備參數精細調控HSs的螺旋角及尺寸(圖2d-e)。表明球體內部的螺旋結構的可調性,為后續功能優化奠定了關鍵基礎。
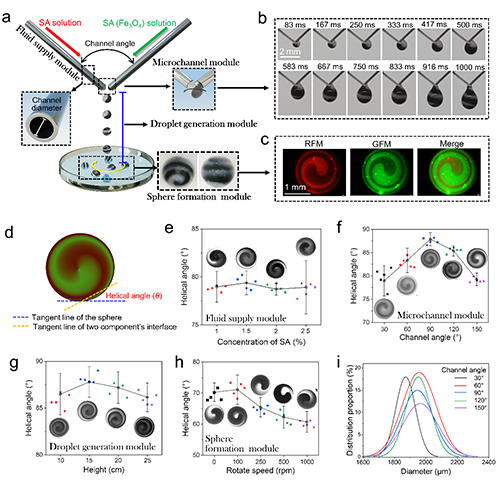
圖2 基于新型微流控裝置制備內螺旋結構可調的HSs
如圖3a所示,他們觀察到,在外部旋轉磁場下,HSs可以同時自旋轉和圓周運動。如圖3b和3d所示,在外部旋轉磁場下,HS-30、HS-60和HS-90在水中完成一次完整的自旋分別需要528±66、474±71和381±56 ms,他們還比較了同一時間段內球體圓周運動的程度(圖3e)。結果表明,螺旋角越大,自旋速度越快,圓周運動速度越慢。為了更好了解HSs的混合能力,他們使用計算流體力學(CFD)來模擬溶劑中的流速和湍流(圖3f)。此外,他們通過將500 μL彩色水溶液與10 mL甘油混合來證明HSs的混合能力(圖3g)。并通過測試均勻混合次數,定量分析混合能力(圖3h)。最后,研究了在有磁場和無磁場下HSs的細胞相容性和血液相容性(圖3i-k)。
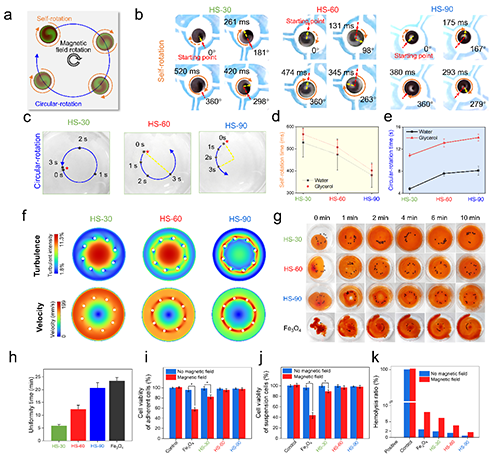
圖3 HSs的微混合性能表征。
HSs不僅可以模擬螺旋螺旋體的旋轉運動,還可以模擬螺旋螺旋體的代謝過程,包括吸附、催化和釋放能力(圖4a)。在磁場的驅動下,HSs可以同時進行旋轉和圓周旋轉,并吸收葡萄糖。圖4b展示了HSs吸附水溶液中的葡萄糖性能。并通過添加葡萄糖催化劑,包括金屬催化劑(TiO, ZnO),酶催化劑(葡萄糖氧化酶(GOD))和細菌(金黃色葡萄球菌),研究了HSs的催化能力(圖4c-g)。此外,還對HSs的釋放能力進行了研究(圖4h-j)。
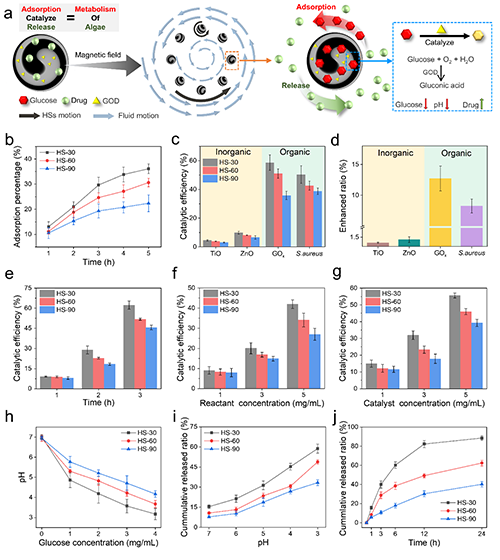
圖4 HSs在磁場中的吸附、催化和釋放能力
控制餐后血糖水平是治療糖尿病的關鍵因素。2型糖尿病大鼠喂養后給予格列本脲、含葡萄糖氧化酶的HSs(HSs /GOD)、含GLIB的HSs(HSs/GLIB)、含GOD和GLIB的HSs(HSs/GOD/GLIB)以控制血糖(圖5a)。圖5f展示了治療7天后,通過測試胰島素抵抗穩態模型(HOMA-IR)來研究不同組的胰島素敏感性。同時記錄不同樣品處理后糖尿病大鼠的體重變化(圖5c)。最后,通過觀察重要器官(如肺、肝、脾、腎和心臟)的HE染色圖像來評估體內生物相容性。如圖5h所示,實驗組與對照組之間無明顯差異,說明HS/GOD/GLIB在有無磁場作用下均具有良好的生物相容性。
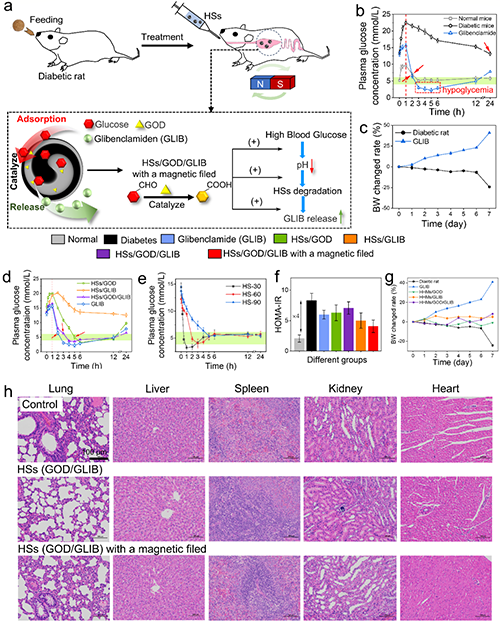
圖5 口服HSs降低2型糖尿病大鼠餐后血糖。
第一作者為南京林業大學森林食物資源挖掘與利用全國重點實驗室博士研究生袁康瑞,共同第一作者為南京林業大學機械電子工程學院賈志成講師;文章的通訊作者為南京林業大學森林食物資源挖掘與利用全國重點實驗室黃超伯教授及中國科學院寧波材料所海洋關鍵材料全國重點實驗室陳濤研究員;特別致謝中山大學第五附屬醫院彭欣副研究員及比利時根特大學StefaanC. De Smedt院士在研究過程中給予的指導與幫助。該成果得到了國家自然科學基金項目資助。
論文全文鏈接:https://doi.org/10.1002/adma.202504878
中比先進生物醫用材料聯合實驗室介紹:https://www.x-mol.com/groups/nfu-ugent
中國科學院寧波材料所智能高分子材料團隊介紹:https://smartpolymers.nimte.ac.cn
- 浙江大學顧臻教授、王金強研究員團隊 Nat. Nanotechnol.:創制血糖響應性胰島素口服制劑 2024-09-03
- 浙大王立教授和俞豪杰副教授團隊 ACS AMI:用于模擬一日三餐血糖控制的葡萄糖響應納米粒子及其微針貼 2023-07-08
- 國科大溫州研究院王毅團隊和東華大學李召嶺團隊 Nano Energy:一種基于石墨烯纖維無紡布的高靈敏度透氣電極用于無創血糖監測 2022-01-05
- 湘潭大學王秀鋒教授 Lab Chip:基于熱反饋實現個性化水合管理的皮膚可貼合微流控技術 2024-11-02
- 湘潭大學王秀鋒/賓州州立程寰宇 Adv Sci:用于汗液定量分析的皮膚可貼合雙流體紙基微流控技術 2024-02-04
- 川大張興棟院士團隊王啟光/樊渝江 AM:靶向軟骨細胞的可注射在體FGF18基因編輯和自潤滑雜化外泌體微凝膠用于骨關節炎治療 2024-01-29
