調(diào)查表明,生物材料相關的感染占院內(nèi)獲得性感染的50%以上,平均感染率在5%左右,感染后死亡率高達10%。感染的發(fā)生機制如下:細菌在生物材料表面黏附,繁殖形成菌落,細菌分泌胞外基質(zhì)形成生物膜,生物膜釋放浮游菌體和毒素,最終導致感染的發(fā)生。其中細菌黏附是最初始也是最重要的步驟之一,因為一旦細菌發(fā)生從可逆黏附到不可逆黏附的轉變,將很難被清除。針對細菌黏附、細菌尸體和細菌生物膜難以清除的關鍵問題,溫州醫(yī)科大學眼視光醫(yī)院王佰亮副研究員、南開輝研究員和陳浩教授的研發(fā)團隊依據(jù)溫敏型聚合物的相轉變特性構建了一類可以可逆殺菌-釋放細菌的智能抗菌表面。
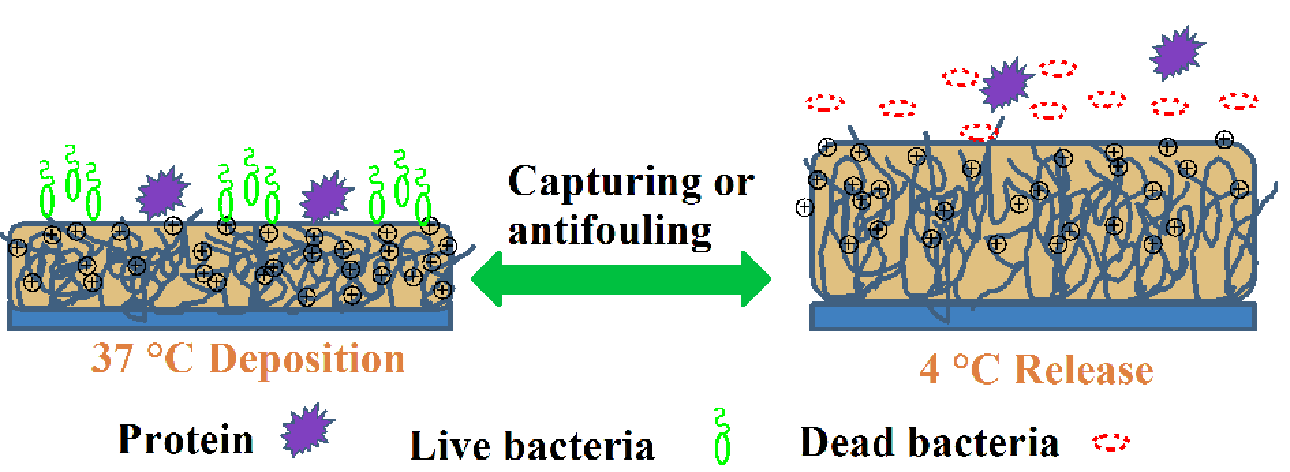
圖1. 溫敏型P(DMAEMA+-co-NIPAAm)聚合物刷的可逆殺菌-自清潔示意圖

圖2. 大腸桿菌和材料接觸培養(yǎng)24h清洗前后的死/活染色熒光圖(P3-7: DMAEMA+和NIPAAm摩爾比為3:7)

圖3. 溫敏型P(VCL-co-DMAEMA+-co-MPC)聚合物刷的可逆殺菌-自清潔示意圖
如圖1和圖2所示,采用表面引發(fā)的可逆加成-斷裂鏈轉移聚合反應技術,研究者首先構建了聚(N-異丙基丙烯酰胺-(2-(二甲基氨基)-甲基丙烯酸乙酯) ) (P(DMAEMA+-co-NIPAAm) )二元共聚物,在37℃表面呈現(xiàn)一定的疏水性,細菌黏附并和季銨鹽組分作用被殺死,降低溫度到4℃后表面發(fā)生從疏水到親水的相轉變,使黏附的細菌被清除,通過四次黏附-釋放循環(huán)實驗證實了該聚合物刷的溫度刺激響應的殺菌-釋放細菌尸體可調(diào)控性。該研究巧妙地將溫敏性組分和殺菌組分復合于材料表面,基于相轉變實現(xiàn)了細菌的可控“吸附”和“釋放”,解決了目前大部分抗菌表面不能有效清除細菌尸體的關鍵問題,通過簡單的溫度調(diào)控實現(xiàn)材料的自清潔和殺菌功能的恢復(相關研究成果發(fā)表在ACS Applied Materials & Interfaces,2016, 8: 27207?27217)。在此基礎上增加親水性組分,如圖3所示,研究者構建了N-乙烯基己內(nèi)酰胺-(2-甲基丙烯酰氧基乙基磷酰膽堿)-(2-(二甲基氨基)-甲基丙烯酸乙酯) (P(VCL-co-DMAEMA+ -co-MPC) )三元共聚物,基于MPC的親水性顯著提高了表面的抗細菌黏附能力。通過對涂層組分的調(diào)控,增強了表面的在自清潔能力,使溫敏性釋放功能具有更高的可重復性(相關研究成果發(fā)表在Biomaterials Science, 2016, 4: 1731-1741,封面報道,并被中華醫(yī)學會眼科學分會評選為“2016年度中國眼科十大創(chuàng)新成就”)。

圖4. 以膠束為納米藥物載體利用層層自組裝技術構建細菌響應性智能抗菌表面
生物材料發(fā)生細菌感染后周圍的微環(huán)境會發(fā)生很大的變化,出現(xiàn)pH值降低、細菌釋放的毒力因子和多種酶等。依據(jù)細菌微環(huán)境的變化構建的抗菌響應型表面更具優(yōu)勢,近年來在國際上已經(jīng)成為研究的重點和熱點。如圖4所示,研究者成功構建了細菌感染微環(huán)境響應性的智能抗菌表面,首先合成了甲氧基聚乙二醇-聚(ε-己內(nèi)酯)-殼聚糖的嵌段共聚物(MPEG-PCL-CS),制成膠束的過程中負載疏水性抗生素,然后和聚丙烯酸(PAA)進行層層自組裝,制備的納米藥物負載體系表現(xiàn)出明顯的pH值響應性和細菌響應性藥物釋放。該研究的針對細菌感染的微環(huán)境特點,構建了對細菌感染自衛(wèi)機制的載藥體系,因此提高了藥物傳遞的“靶向性”,在提高抗菌效率和抑制細菌耐藥性方面具有重要意義(相關研究成果發(fā)表在Journal of Materials Chemistry B, 2017, 5: 1498-1506)。
- 弗吉尼亞理工大學田芝婷教授課題組:溫敏型聚合物水溶液的熱導率改變 2018-01-15
