菌耐藥性已經(jīng)成為公共健康領(lǐng)域一項(xiàng)全球性挑戰(zhàn);顯著提高藥物的生物利用度和降低使用劑量的納米載體輸運(yùn)體系是降低抗生素耐藥性發(fā)生頻率的一條有效途徑。基于納米粒子的藥物載體能夠提高藥物溶解度和穩(wěn)定性,優(yōu)化藥代動(dòng)力學(xué)和生物分布,延長(zhǎng)循環(huán)半衰期,降低系統(tǒng)性毒性,并降低抗生素耐藥性的發(fā)生頻率。
但是,已有的載體體系還具有很大的局限性。例如,基于聚乙丙交酯(PLGA)的生物可降解納米載體通常只能夠輸運(yùn)疏水性的抗菌藥物,在很大程度上限制了它們的應(yīng)用范圍。能夠同時(shí)負(fù)載親水和疏水抗菌藥物的聚合物囊泡能夠克服這一局限性,但在載體穩(wěn)定性,響應(yīng)性釋放機(jī)制和位點(diǎn)特異性方面還需要進(jìn)一步探索。
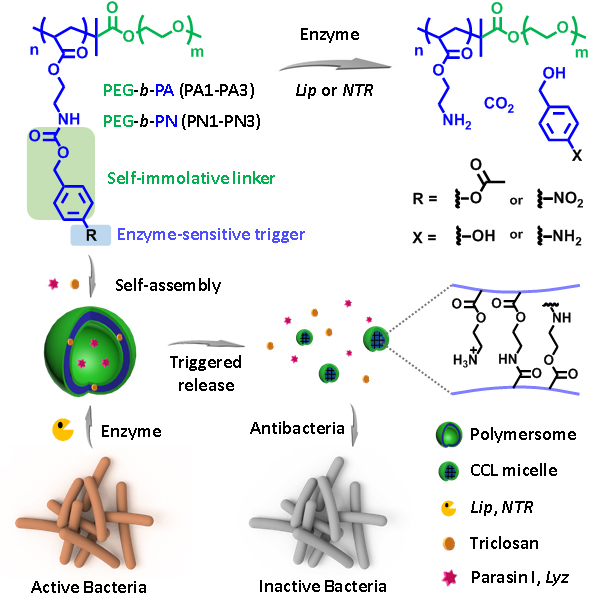
(細(xì)菌酶觸發(fā)酶響應(yīng)性聚合物囊泡釋放抗菌劑的示意圖)
中國(guó)科技大學(xué)化學(xué)與材料科學(xué)學(xué)院高分子科學(xué)與工程系劉世勇教授課題組李亞明博士通過(guò)可控自由基聚合合成了具有脂酶和硝基還原酶響應(yīng)性的兩親性二嵌段共聚物PEG-b-PA和PEG-b-PN,并通過(guò)可控自組裝的方式制備了聚合物囊泡結(jié)構(gòu)。聚合物囊泡在相應(yīng)的酶作用下能夠發(fā)生囊泡-核交聯(lián)膠束的形貌轉(zhuǎn)變以及組裝體內(nèi)部疏水微區(qū)極性的反轉(zhuǎn)。利用這一變化過(guò)程,將親水性和疏水性的抗菌物質(zhì)負(fù)載在酶響應(yīng)聚合物囊泡中,并研究了其針對(duì)幾種常見(jiàn)的細(xì)菌和真菌的生長(zhǎng)抑制效果,結(jié)果表明在相應(yīng)酶存在的條件下,其具有良好的生長(zhǎng)抑制效果。

(可控自由基聚合制備脂酶和硝基還原酶響應(yīng)性的兩親性二嵌段共聚物PEG-b-PA和PEG-b-PN路線圖)

(脂酶和硝基還原酶響應(yīng)性嵌段聚合物囊泡的電鏡和動(dòng)態(tài)光散射表征結(jié)果)

(聚合物囊泡在相應(yīng)的酶作用下能夠發(fā)生囊泡-核交聯(lián)膠束的形貌轉(zhuǎn)變以及組裝體內(nèi)部疏水微區(qū)極性的反轉(zhuǎn)的可能機(jī)理)

(負(fù)載抗菌物質(zhì)的酶響應(yīng)聚合物囊泡在相應(yīng)酶存在條件下具有良好的生長(zhǎng)抑制效果)
這一研究工作最近發(fā)表在高分子科學(xué)的專業(yè)期刊高分子學(xué)報(bào)上(DOI: 10.11777/ j.issn1000-3304.2017.17035)上,李亞民博士為該論文第一作者,劉世勇教授為通訊作者。
參考文獻(xiàn)
Ya-min Li, Shi-yong Liu. Enzyme-triggered Transition from Polymeric Vesicles to Core Cross-linked Micelles for Selective Release of Antimicrobial Agents. Acta Polymerica Sinica, 2017, (7): 1178 - 1190
論文鏈接:
DOI: 10.11777/j.issn1000-3304.2017.17035
- 華東理工林紹梁/靳海寶團(tuán)隊(duì)、上海交大周永豐 Angew:通過(guò)調(diào)節(jié)偶氮苯對(duì)位取代基的電子效應(yīng)制備具有可控光響應(yīng)性的超薄聚合物囊泡 2025-02-22
- 四川大學(xué)丁明明和譚鴻教授團(tuán)隊(duì)Angew:高分子構(gòu)象轉(zhuǎn)變調(diào)節(jié)囊泡膜通透性 2021-08-19
- 西南交大周紹兵教授團(tuán)隊(duì)《Sci. Adv.》:聚合物囊泡同時(shí)引發(fā)內(nèi)質(zhì)網(wǎng)應(yīng)激和自噬流阻斷,有效抗腫瘤及抑制腫瘤轉(zhuǎn)移 2020-08-05
