導(dǎo)電水凝膠由于其具有高含水量、超強(qiáng)、可拉伸等特性,可廣泛應(yīng)用于人工肌肉、軟骨修復(fù)、電子皮膚、生物傳感器等領(lǐng)域。然而,由于導(dǎo)電高分子不溶于水,難以分散在水凝膠的聚合物網(wǎng)絡(luò)中;且生物相容性差。因此,制備具有良好機(jī)械性能、導(dǎo)電性和生物相容性、可以在生物醫(yī)學(xué)領(lǐng)域廣泛應(yīng)用的導(dǎo)電水凝膠仍是一種挑戰(zhàn)。
針對(duì)以上問(wèn)題西南交通大學(xué)魯雄教授課題組提出用生物高分子為模版控制導(dǎo)電高分子通路在水凝膠中原位形成的設(shè)計(jì)策略,采用生物相容性良好的殼聚糖與丙烯酰胺形成互穿網(wǎng)絡(luò)水凝膠。以殼聚糖為模版誘導(dǎo)導(dǎo)電高分子單體在水凝膠中的吸附,并原位氧化聚合,從而使得導(dǎo)電高分子在殼聚糖分子的纏結(jié)區(qū)形成導(dǎo)電納米棒,成功制備出兼具導(dǎo)電、超強(qiáng)、可拉伸、生物相容性好的導(dǎo)電水凝膠。研究結(jié)果表明,這種通過(guò)殼聚糖分子模版控制導(dǎo)電聚合物聚吡咯在水凝膠中原位形成的導(dǎo)電通路,賦予該水凝膠良好的導(dǎo)電性能(0.3 S/m)。此外,由于氧化劑鐵離子可以與殼聚糖分子配位形成鏈纏結(jié),從而形成物理交聯(lián)的第二網(wǎng)絡(luò),賦予改水凝膠超強(qiáng)的機(jī)械性能(斷裂能12000 J/m2,壓縮模量 136 MPa),遠(yuǎn)超常見(jiàn)的導(dǎo)電水凝膠。該超強(qiáng)導(dǎo)電水凝膠可作為傳感器用于檢測(cè)人體生理信號(hào)和作為藥物控釋系統(tǒng)用于電刺激藥物可控釋放。該研究成果以“Conductive and Tough Hydrogels Based on Biopolymer Molecular Templates for Controlling in Situ Formation of Polypyrrole Nanorods”為題在線發(fā)表于《ACS Applied materials &interface》。論文第一作者為在讀博士研究生甘東林。該研究得到了國(guó)家重點(diǎn)研發(fā)計(jì)劃,國(guó)家自然科學(xué)基金等項(xiàng)目支持。
圖1. 基于分子模板的導(dǎo)電水凝膠的設(shè)計(jì)思路
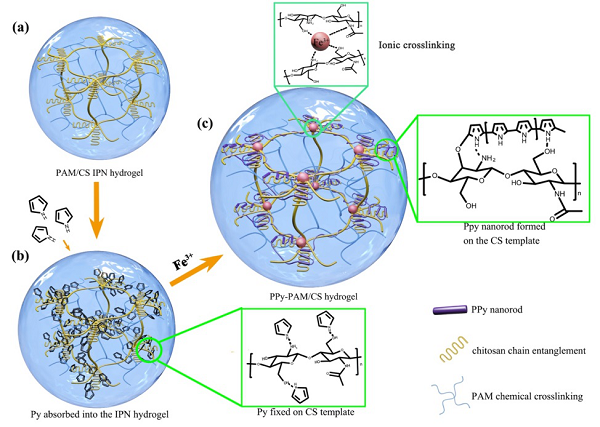
a)聚丙烯酰胺殼聚糖互傳網(wǎng)絡(luò)水凝膠的合成;b)殼聚糖分子模版誘導(dǎo)吡咯單體在水凝膠中的吸附,以及吡咯單體在殼聚糖纏結(jié)區(qū)富集;c)殼聚糖分子模版控制聚吡咯在水凝膠中原位形成,聚吡咯導(dǎo)電通路與殼聚糖鏈纏繞,聚吡咯納米棒在殼聚糖纏結(jié)區(qū)形成。
圖2. 水凝膠機(jī)械性能
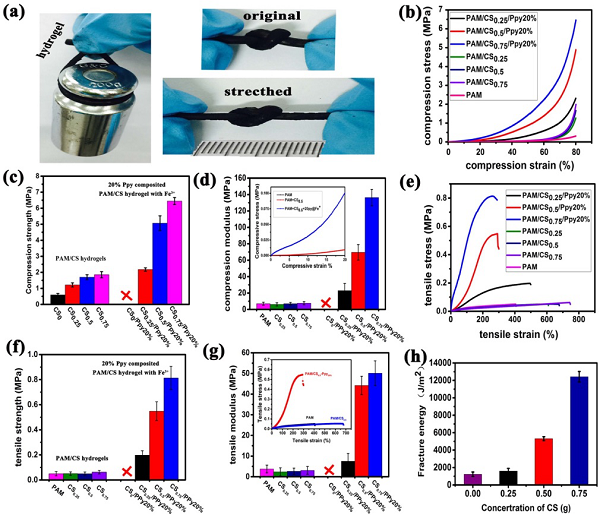
a)水凝膠負(fù)載和打結(jié)拉伸展示;b)不同水凝膠壓縮應(yīng)力應(yīng)變曲線;c)不同殼聚糖含量的水凝膠壓縮強(qiáng)度;d)不同殼聚糖含量的水凝膠壓縮模量;e)不同水凝膠拉伸應(yīng)力應(yīng)變曲線;f)不同殼聚糖含量的水凝膠拉伸強(qiáng)度;g)不同殼聚糖含量的水凝膠拉伸模量;h)不同殼聚糖含量的導(dǎo)電水凝膠的斷裂能。
圖3. 水凝膠導(dǎo)電性能

a)導(dǎo)電水凝膠連接在水凝膠中并照亮LED燈;b)不同吡咯含量導(dǎo)電水凝膠的電導(dǎo)率;(c)水凝膠附著在作者的手腕上,通過(guò)檢測(cè)電流變化實(shí)時(shí)監(jiān)測(cè)人體運(yùn)動(dòng);(d)水凝膠作為應(yīng)力傳感器來(lái)檢測(cè)負(fù)荷。
圖4導(dǎo)電水凝膠電刺激控制藥物釋放的檢測(cè)

圖4(a)導(dǎo)電水凝膠對(duì)地塞米松(DEX)負(fù)載和釋放示意圖。 當(dāng)施加負(fù)電位時(shí),通過(guò)氧化還原過(guò)程釋放藥物。 b)在沒(méi)有電刺激的情況下,DEX從PAM / CS水凝膠中釋放出來(lái),而在PPy-PAM / CS水凝膠不釋放出DEX。 (c)在電刺激下,DEX從具有不同PPy含量的水凝膠中釋放。 (d)在不同電壓的電刺激下,DEX從20%PPy-PAM / CS水凝膠中釋放。
圖5導(dǎo)電水凝膠電刺激控制細(xì)胞的行為
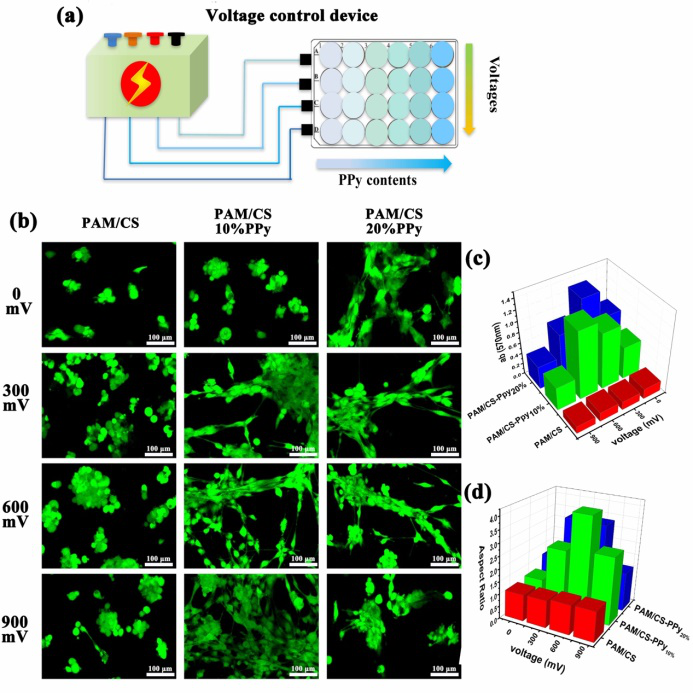
a)高通量電刺激C2C12細(xì)胞示意圖;b-d)不同刺激電壓下,不同PPy含量對(duì)C2C12在水凝膠上增殖行為和形貌的影響。
圖6水凝膠用于修復(fù)大鼠層皮膚缺損模型。

a)水凝膠植入的示意圖。b)在植入不同時(shí)期后用PAM / CS,PPy-PAM / CS和EGF負(fù)載的PPy-PAM / CS處理皮膚缺損的外觀照片。c)隨之植入時(shí)間傷口愈合百分比。d)21天后,傷口切片的H&E染色。
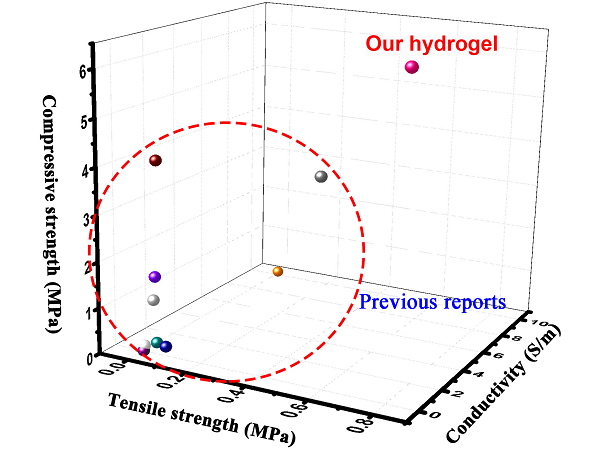
圖7與現(xiàn)有導(dǎo)電復(fù)合水凝膠相比該水凝膠具有較強(qiáng)的機(jī)械性能和良好的導(dǎo)電性
本研究設(shè)計(jì)了一種新型的基于生物高分子模板的方法來(lái)制備由CS和PPy組成的超強(qiáng)、導(dǎo)電、生物相容好的水凝膠。殼聚糖分子框架在親水性水凝膠基質(zhì)中充當(dāng)疏水性PPy納米棒的聚合模板,使得PPy納米棒均勻分布在PAM / CS IPN水凝膠中,從而形成導(dǎo)電通路以賦予水凝膠優(yōu)良導(dǎo)電性。 這種由生物高分子模板控制的原位合成PPy納米棒的新策略,克服了疏水性導(dǎo)電聚合物難以均勻摻入親水性水凝膠中形成貫通導(dǎo)電網(wǎng)絡(luò)的難題,為導(dǎo)電水凝膠制備的提供新的設(shè)計(jì)思路。
文章鏈接:https://pubs.acs.org/articlesonrequest/AOR-izz9pRSd58Fcqmie7YVW
- 蘭州理工大學(xué)冉奮教授團(tuán)隊(duì) Nat. Commun.:肝素?fù)诫s導(dǎo)電聚合物 2024-12-07
- 西南交大魯雄/中國(guó)海大韓璐/北京基礎(chǔ)醫(yī)學(xué)研究所江小霞等Nano Today:導(dǎo)電粘附水凝膠調(diào)控創(chuàng)傷性腦損傷后的神經(jīng)炎癥與神經(jīng)功能 2023-07-23
- 北大裴堅(jiān)教授、王婕妤教授團(tuán)隊(duì)《Sci. Adv.》:?jiǎn)我还曹椌酆衔飳?shí)現(xiàn)超高n型和p型導(dǎo)電率和功率因子 2023-03-05
- 西南林大杜官本教授、楊龍研究員團(tuán)隊(duì) Nat. Commun.:碳化聚合物點(diǎn)誘導(dǎo)結(jié)晶域集成取向調(diào)控構(gòu)建強(qiáng)健和堅(jiān)韌水凝膠 2025-07-07
- 中山大學(xué)吳丁財(cái)/黃榕康/鄭冰娜/王輝團(tuán)隊(duì) Adv. Mater.:具有長(zhǎng)駐留性的可注射多孔炭納米酶水凝膠實(shí)現(xiàn)腫瘤的協(xié)同治療 2025-07-04
- 重醫(yī)大毛翔團(tuán)隊(duì)、哈工大賀良燦團(tuán)隊(duì) Small 綜述:復(fù)合水凝膠的創(chuàng)新與應(yīng)用-從聚合物體系到摻金屬離子和功能性納米材料增強(qiáng)型結(jié)構(gòu) 2025-07-04
- 武漢大學(xué)陳朝吉、高恩來(lái)/林科院林化所劉鶴 AFM:二氧化碳衍生多功能生物基非異氰酸酯聚氨酯助力紙張轉(zhuǎn)化為紙塑 2025-06-30
