多重耐藥性細菌引起的感染日益威脅著人類的健康。據估計,到2050年,在世界范圍內細菌耐藥性的持續上升將導致每年多達1000萬人死亡,超過了癌癥死亡的發生率。細菌對抗生素治療的頑固抗性不僅來自浮游細菌的基因突變或結構轉化,還來自生物被膜的形成,生物被膜為內部的細菌提供了相對穩定的生存環境,其中大量的胞外聚合物基質(EPS)具有屏障作用,阻礙抗生素的滲透,同時能幫助其抵抗宿主免疫系統的防御,使細菌感染的治療復雜化。利用納米材料的多功能性和靈活性提高藥物在生物被膜內的局部有效濃度是解決這類問題的一個思路。

圖1. 負載三氯生納米膠囊PMPC-CS的制備
為了使納米材料有效的停留在感染部位,進而高效清除細菌,通常需要其具有正電性的表面,正電性的納米材料可通過靜電相互作用吸附在細菌細胞膜上,釋放的藥物能夠很快地被細菌攝取。但不利的一方面是,EPS占生物被膜總量的90%以上,傳統的正電性納米材料也會與生物被膜中大量的負電性EPS組分靜電相互作用,這將阻礙納米材料在生物被膜內部的深入滲透與擴散,從而影響治療效果。
最近,劉陽研究員團隊設計了一種具有核殼結構的納米膠囊,以聚2-甲基丙烯酰氧乙基磷酸膽堿共聚物(PMPC)為殼層,殼聚糖納米粒子(CS)為內核,隨后負載抗菌劑用于生物被膜的治療(如圖1所示)。像聚2-甲基丙烯酰氧乙基磷酸膽堿這類兩親性離子聚合物,相對于PEG而言能夠更強地結合水分子,形成水合層,抵抗非特異性蛋白質的吸附,是一種用于生物被膜滲透的理想材料。因此PMPC外衣賦予了納米膠囊低EPS粘附的特性,幫助其穿透生物被膜的屏障,同時內核殼聚糖的正電性使納米膠囊能夠與細菌結合,最終達到藥物的原位釋放,這一復合特性使納米載體同時實現了在生物被膜內部有效滲透與停留的最佳效果。

圖2. (a) 納米膠囊與EPS組分的作用情況;(b) 納米膠囊與細菌S. aureus ATCC12600GFP的相互作用情況
然而,隨著納米膠囊中正電性鏈段與兩親性鏈段 (PAPM : PMPC) 比例的提高,納米膠囊的對 EPS 組分的吸附也增加。這是由于隨著聚合時 APM : MPC比例的提高,納米膠囊的正電性增強,從而促進了納米膠囊與EPS 組分的靜電相互作用。另一方面,引入APM降低了納米膠囊表面MPC的作用,直接減弱了納米膠囊抗EPS吸附的能力。此外,分析實驗結果發現,在 pH 7.4 時,P(MPC1-co-APM1)-CS和P(MPC1-co-APM4)-CS表現出相近的電位,但對 EPS 的吸附情況有較為明顯的差異,這一現象暗示了納米膠囊的表面性質直接影響了其在滲透過程中與生物被膜組分EPS的相互作用,從而在生物被膜中呈現出不同的滲透和積累效果。
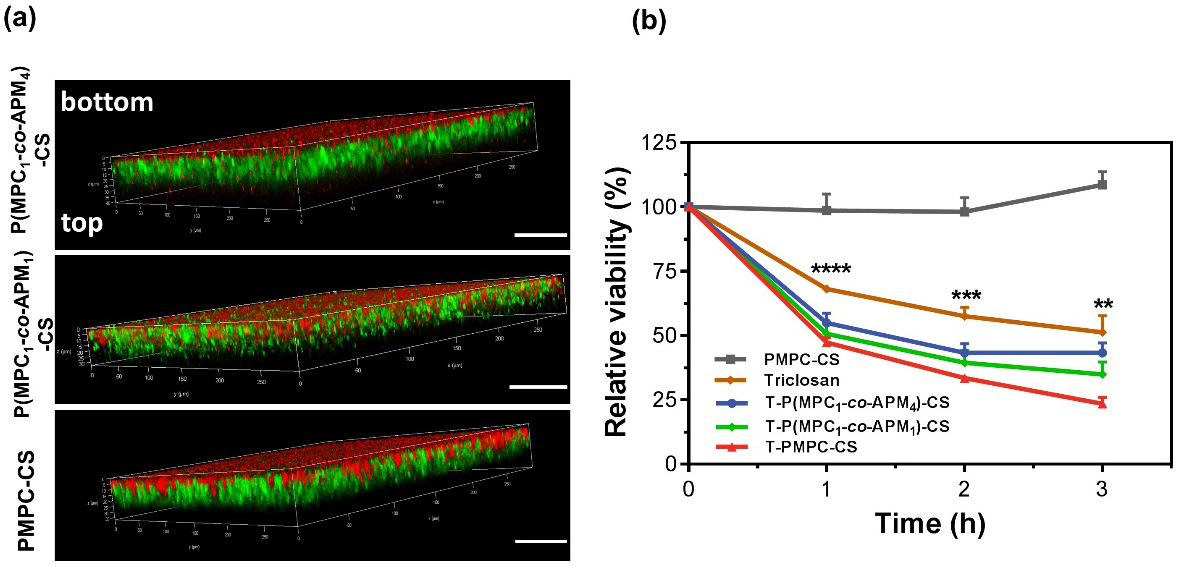
圖3. (a) 納米膠囊在生物被膜內的滲透與停留情況;(b) 納米膠囊、游離三氯生及負載三氯生的納米膠囊對生物被膜的抑制效果
此外,納米載體利用內核殼聚糖在生物被膜酸性微環境下的溶脹效應,實現藥物的酸響應釋放。最終結果顯示,與游離的抗菌劑相比,載藥納米膠囊表現出對耐藥性細菌生物被膜更為有效的治療效果,提高了抗菌劑的殺菌效率,克服了生物被膜的抗性。該團隊構建的抗生物被膜感染的pH響應性多功能納米遞送系統,集成生物相容性、生物被膜組織的滲透、靶向遞送藥物等多種功能,調控載體表面特性將抗菌劑投遞到感染部位的生物被膜內部,發揮高效抗菌作用,為治療與細菌相關的感染提供了新的思路。
以上的研究成果發表在ACS Macro letters (ACS Macro Lett. 2019, 8, 651?657)上。論文第一作者為南開大學化學學院碩士生曹京京,通訊作者為劉陽研究員和史林啟教授。
- 北化徐福建/段順、北京口腔醫院孫玉潔團隊 Adv. Mater.:種植體表面化學結構調控細胞-細菌競爭性行為 2025-07-04
- 西南大學康燕堂/徐立群/徐琨 Adv. Mater.:空心普魯士藍納米框架仿生增強梯度抗菌涂層 2025-07-01
- 蘇大李剛、附一院李峰和附四院沈罡 IJBM: 兼具抗菌和抗狹窄功能的載藥可降解輸尿管支架 2025-06-29
- 東北大學徐大可教授、李祥宇研究員團隊 Angew:生物被膜框架衍生的結構自適應超滑防污防腐涂層 2025-04-14
- 北京化工大學王興教授團隊《ACS Nano》:聚(D-氨基酸)納米粒子通過干擾葡萄球菌肽聚糖合成介導生物被膜瓦解 2024-03-13
- 北京化工大學王興教授團隊 ACS AMI:GSH/pH級聯響應納米粒子通過協同的光和化學療法消除耐甲氧西林金黃色葡萄球菌生物被膜 2024-01-29
- 西南林杜官本/徐開蒙、UT王思群 Carbohyd. Polym.:纖維素、殼聚糖與ZIF-8電紡納米纖維制備及對銅離子高效吸附 2025-04-21
