腫瘤內葡萄糖耗竭誘導的癌癥饑餓療法(tumor starvation)代表了抗癌治療的重要策略,但它通常受到全身毒性,非特異性和平行能量供應的適應性發展的限制。葡萄糖氧化酶(GOx)有效地將葡萄糖氧化成葡萄糖酸和過氧化氫(H2O2),并且已經證明它通過直接葡萄糖消耗在癌癥抑制中是有效的。但是,目前仍然存在與此相關的問題。比如,葡萄糖氧化的副產物H2O2會導致DNA損傷和基因突變從而引起全身毒性;正常細胞中葡萄糖的相似代謝需求可引起嚴重的脫靶效應;癌細胞可以通過其他相似途徑獲取能量導致饑餓療法的失敗。因此,必須將智能材料設計概念結合到治療模式中,從而能夠有效地消除腫瘤內葡萄糖,具有高特異性和低毒性,用于癌癥饑餓治療。
最近,來自中國科大生命科學學院的王育才教授研究團隊在ACS Nano上報道了一種BSA包被的納米級聯簇化酶(BCETPZ@(GOx+CAT)在循環過程中保持穩定,不會引起全身毒性,并且能夠在輕度酸性腫瘤微環境中釋放GOx和CAT,消耗腫瘤部位葡萄糖同時造成乏氧環境激活乏氧前藥,從而實現低毒性腫瘤饑餓并產生局部缺氧以激活化學療法的協同治療(圖1)。
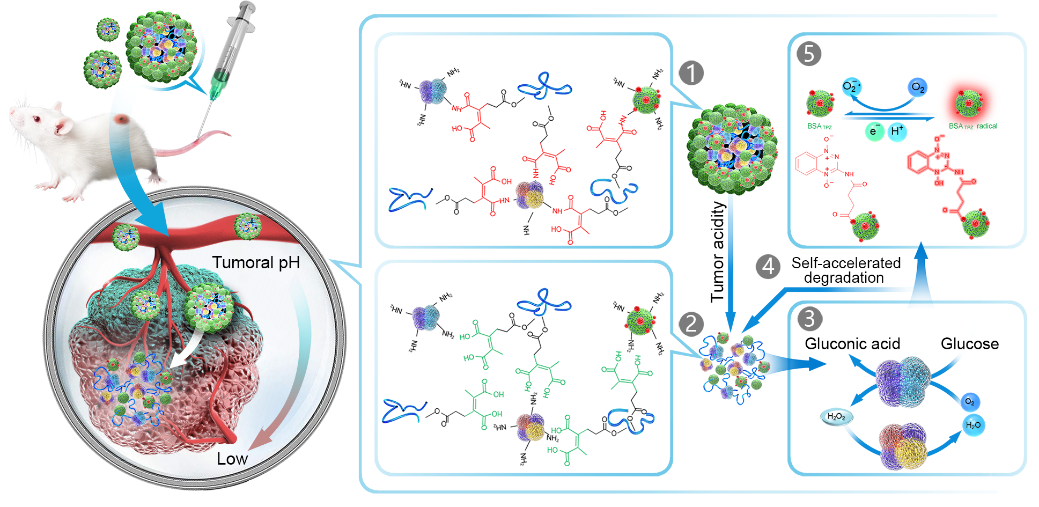
圖1、BCETPZ@(GOx+CAT)在體內的工作原理示意圖:(1)白蛋白外殼在循環過程中可以防止酶快速,過早地暴露在血液中;(2)在腫瘤酸性微環境中選擇性釋放級聯酶;(3)GOx消耗腫瘤部位氧氣(O2)并造成缺氧環境,產生H2O2和葡萄糖酸,而CAT將產生的H2O2轉化為H2O而不會引起全身毒性;(4)步驟3中產生的葡萄糖酸進一步加速納米簇酶的降解;(5)在缺氧環境中通過還原酶活化乏氧前藥BSATPZ,協同葡萄糖消耗腫瘤饑餓療法。
研究者首先合成嵌段共聚物PEG-b-PHEMACMA,通過酸酐與蛋白的氨基交聯制備納米顆粒,調節聚合物與蛋白的不同比例成功制備具有白蛋白外殼且尺寸約為200 nm的納米簇化酶。當重量比設定為1:1時,由DLS測量形成尺寸為~600 nm的大聚集體。而當比例增加到5:1時,形成顆粒尺寸~180 nm且分布均一的納米簇化酶(圖2)。研究發現,在pH 7.4的葡萄糖溶液中,BSA的存在可以有效減緩GOx與葡萄糖的接觸;在pH 6.5的葡萄糖溶液中,納米簇化酶可以快速崩解釋放原酶。通過粒徑表征,溶液中pH變化,溶液中溶解氧和葡萄糖濃度變化成功驗證BCE@(GOx+CAT)能夠在類腫瘤微酸性環境中選擇性地釋放原酶,而在中性條件下保持穩定,同時保留了持續消耗O2和葡萄糖的能力(圖3)。

圖2、納米簇化酶的大小控制示意圖
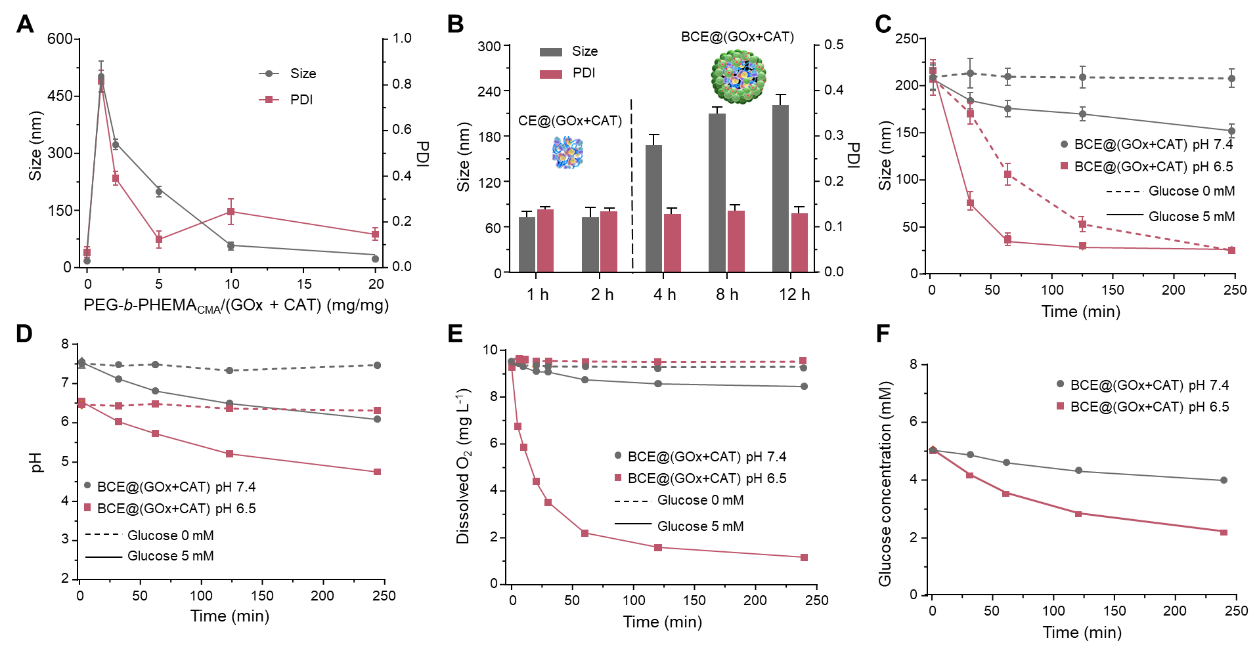
圖3、納米簇化酶的制備和原酶的釋放。(A)CE@(GOx+CAT)的粒徑分析;(B)在添加BSA前后,納米簇化酶的粒徑分析;BCE@(GOx+CAT)的(C)粒徑,(D)pH值,(E)溶解O2和(F)葡萄糖濃度的時間依賴性變化(GOx:2 U/mL,CAT:240 U/mL)。
在驗證了納米簇化酶BCE@(GOx+CAT)在腫瘤中的積累后,他們研究了納米簇化酶在腫瘤內消耗氧的能力。隨著納米簇化酶靜脈注射樣品后24小時內,通過乏氧綠色熒光信號的熒光進行觀察分析可以看出綠色熒光信號的強度在逐漸增加,表明納米簇化酶可以迅速消耗腫瘤中的O2,并且,注射后48小時腫瘤內部仍然顯示出較強的綠色熒光信號,顯示了其持續消耗葡萄糖和氧氣的能力。上述結果表明,荷瘤小鼠在靜脈注射BCE@(GOx+CAT)后將有效消耗并清除腫瘤內部的O2,導致腫瘤乏氧明顯增強(圖3)。

圖4、(A)注射BCE@(GOx+CAT)后評估腫瘤乏氧程度的示意圖。(B)用Hypoxyprobe試劑盒對腫瘤切片進行熒光染色的代表性免疫熒光圖像。
該研究成功展示了一種通過結合靶向腫瘤饑餓和脫氧激活化療來強化癌癥治療的級聯催化納米藥物的方法。納米藥物在血液循環過程中保持穩定并僅在腫瘤微酸環境釋放原酶快速耗盡腫瘤細胞中的葡萄糖和O2,實現低毒性的腫瘤的饑餓療法,并產生局部缺氧來激活化療。這一策略提供了一個創新的腫瘤饑餓和脫氧激活化療的協同治療設計方式,從而提高抑制腫瘤效果。
中國科大博士生馬寅初、趙陽陽與博士后納文博士為本論文共同第一作者,王育才教授為本文的通訊作者。
該工作得到了國家自然科學基金(NOs. 51773191, 51573176, 51633008),國家重點研發計劃(2017YFA0205600)的資助。
論文題目為“Nanoclustered Cascaded Enzymes for Targeted Tumor Starvation and Deoxygenation-Activated Chemotherapy without Systemic Toxicity”
- 中國科大陳昶樂/安大陳敏、張文建 Angew:ROMP-RAFT串聯聚合新方法制備聚烯烴多嵌段共聚物 2025-07-02
- 天津大學/北京大學 Sci. Adv.:基于光子微球索引的高容量DNA數據存儲隨機訪問技術 2025-06-21
- 青科大李志波/劉紹峰教授團隊 ACS Catal.: 新型鉿金屬催化劑鏈穿梭聚合制備高熔點烯烴嵌段共聚物OBC 2025-05-11
- 東華大學郭睿教授/史向陽教授課題組《ACS AMI》:樹枝大分子包裹銅鉑雙金屬納米酶用于腫瘤微環境調控光熱/催化療法 2025-06-19
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 武漢大學張先正教授團隊《Nano Lett.》:微藻基“活”凝膠瘤內光合作用增強腫瘤饑餓/免疫療法 2024-03-16
