由于在實體瘤深層部位缺乏淋巴細胞浸潤并且存在多種免疫逃逸機制,因此腫瘤深處逆轉免疫抑制對于臨床癌癥治療至關重要,但仍然存在巨大挑戰。最近,來自中國科大生命科學學院的王育才教授團隊與合肥工業大學的王峰教授團隊合作在ACS Nano上報道了一種使用第二紅外窗口的紅外光(NIR(II))光熱療法在實體瘤中觸發更均一和更深的免疫原性細胞死亡,從而引發了針對腫瘤控制和轉移預防的先天性和適應性免疫應答。在體外,光熱處理會導致腫瘤細胞免疫原性死亡(ICD),并伴隨著損傷相關分子模式(DAMPs)的釋放。在體內,NIR(II)光熱導致DAMPs在腫瘤深處的釋放和分布更加均勻。NIR(II)光熱療法誘導ICD后可以同時觸發了先天性和適應性免疫反應,并實現了有效的腫瘤治療,其中有5/8的小鼠在腫瘤疫苗接種檢測中保持無腫瘤狀態。此外,NIR(II)光熱療法與檢查點阻斷療法相結合,對原發性和遠端腫瘤均進行了長期的腫瘤抑制。最后,使用全身給藥的修飾過的2D聚吡咯納米片(Em@PPy)作為NIR(II)光熱試劑,通過協同的光熱免疫反應,實現了針對全身腫瘤轉移的驚人治療效果。

圖1、示意圖顯示NIR(II)光熱誘導的免疫原性死亡如何促進先天性和適應性抗腫瘤免疫,從而進一步增強α-PD-1檢查點阻斷免疫治療。實體瘤的深部和內部具有低pH值,低氧分壓,淋巴細胞浸潤較少以及免疫逃逸的特征。NIR(II)光熱誘導細胞凋亡(#1),隨后釋放腫瘤相關抗原(TAA)(#2)和DAMPs(#3)。DAMPs促進DC吞噬TAA(#4),從而促進其腫瘤抗原呈遞給CD8+ T細胞(#5)并激活TAA特異性細胞毒性T淋巴細胞(CTL)(#9)和記憶T細胞(#10)用于控制腫瘤和預防復發(#11)。從成熟DC(#6)和凋亡腫瘤細胞(#7)釋放的細胞因子增加MHC在抗原呈遞細胞(APC)上的I類表達,并促進T細胞分化。α-PD-1(#12)的聯合遞送促進CTL(#13)的增殖和活性,抑制了Tregs細胞和CTL之間的抑制信號(#14和#15),并進一步增強了由NIR(II)光熱觸發的ICD的治療作用。ICD誘發的全身性抗癌免疫反應可預防腫瘤轉移(#16)。
研究者首先合成采用不同粒徑的金納米顆粒與脂質體DOPC簡單混合制備金脂質體復合物Au-DOPC,金納米顆粒在脂質體表面的聚集可以導致LSPR的紅移,而隨著金納米顆粒大小的增加,LSPR的紅移也在增加。將直徑為15,30和40 nm的AuNPs(即Au15C,Au30C和Au40C)與DOPC混合,產生的聚集體的LSPR位于~660 nm,~800 nm和NIR(II)(~1000nm)窗口(圖2)。

圖2、可控的AuNPs在脂質體DOPC上自組裝可實現不同生物窗口光熱
之后,研究了不同生物窗口中的光熱是否可以誘導DAMPs從垂死的細胞中釋放,這是ICD的最重要特征之一。基于熒光素酶的探針,觀察到在45 ℃和50 ℃的光熱后4小時內,細胞外ATP從2 nM增加到12 nM,然后在24 h內逐漸降低。FACS檢測顯示了CALR的暴露是溫度依賴性的,CALR在50 ℃ 光熱處理后表達最高,在較低溫度下降低并且與激光波長大小無關。在激光照射后12 h,50 ℃ 光熱處理還顯著增加了HMGB1從細胞核到細胞外空間的轉運。光熱處理后的死亡細胞中上述DAMPs的產生表明光熱處理可以誘導溫度依賴性ICD表型(圖3)。

圖3、NIR(II) 光熱誘導4T1腫瘤細胞體外釋放DAMPs。
接著,研究者對NIR(II)光熱在體內誘導免疫原性死亡產生DAMPs表型的能力進行研究。實驗結果表明45 ℃和50 ℃ 光熱引起細胞骨架和細胞核的形態變化和變形,并且CALR暴露顯著增加,幅度為50 ℃ > 45 ℃ > 40 ℃,與體外結果一致。同時,NIR(II)光熱處理增加了腫瘤中HMGB1的釋放。進一步比較了實體瘤中NIR(I)和NIR(II)激光照射導致ICD 變化。結果顯示,對于1064和808 nm激光照射,分別在大約6毫米和3毫米的深度處可以在腫瘤內實現顯著的CALR暴露。上述現象證明了使用NIR(II)光熱引起DAMPs在更深的腫瘤部位釋放的巨大前景,這將在更深的腫瘤中產生更有效的免疫反應和更好的反向免疫抑制(圖4)。
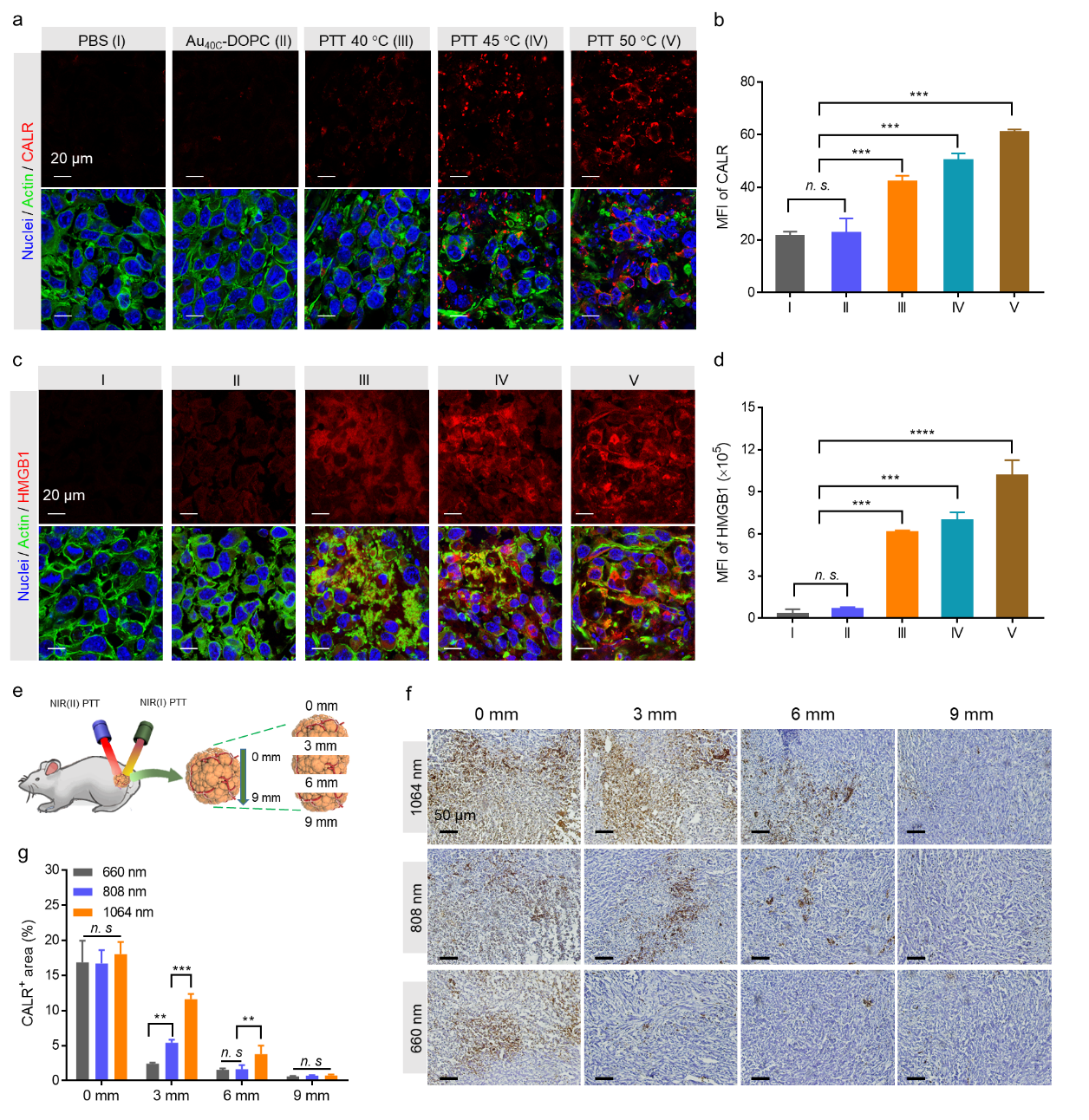
圖4、NIR(II)光熱誘導腫瘤深部區域中更顯著的DAMPs釋放
最后,基于NIR(II)光熱可以引起全身抗腫瘤免疫力的增強,進一步研究了其抑制腫瘤轉移的潛力。采用二硬脂酰磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)和紅細胞膜修飾的超薄PPy(Em@PPy)用作NIR(II)光熱的光熱試劑。NIR(II)光熱,Imi聯合α-PD-1治療可顯著抑制腫瘤轉移,并且顯著減少了腫瘤結節的數量。NIR(II)介導的ICD可能是一種敏化α-PD-1檢查點阻斷免疫療法的有效方法,在臨床上預防腫瘤轉移方面很有希望。
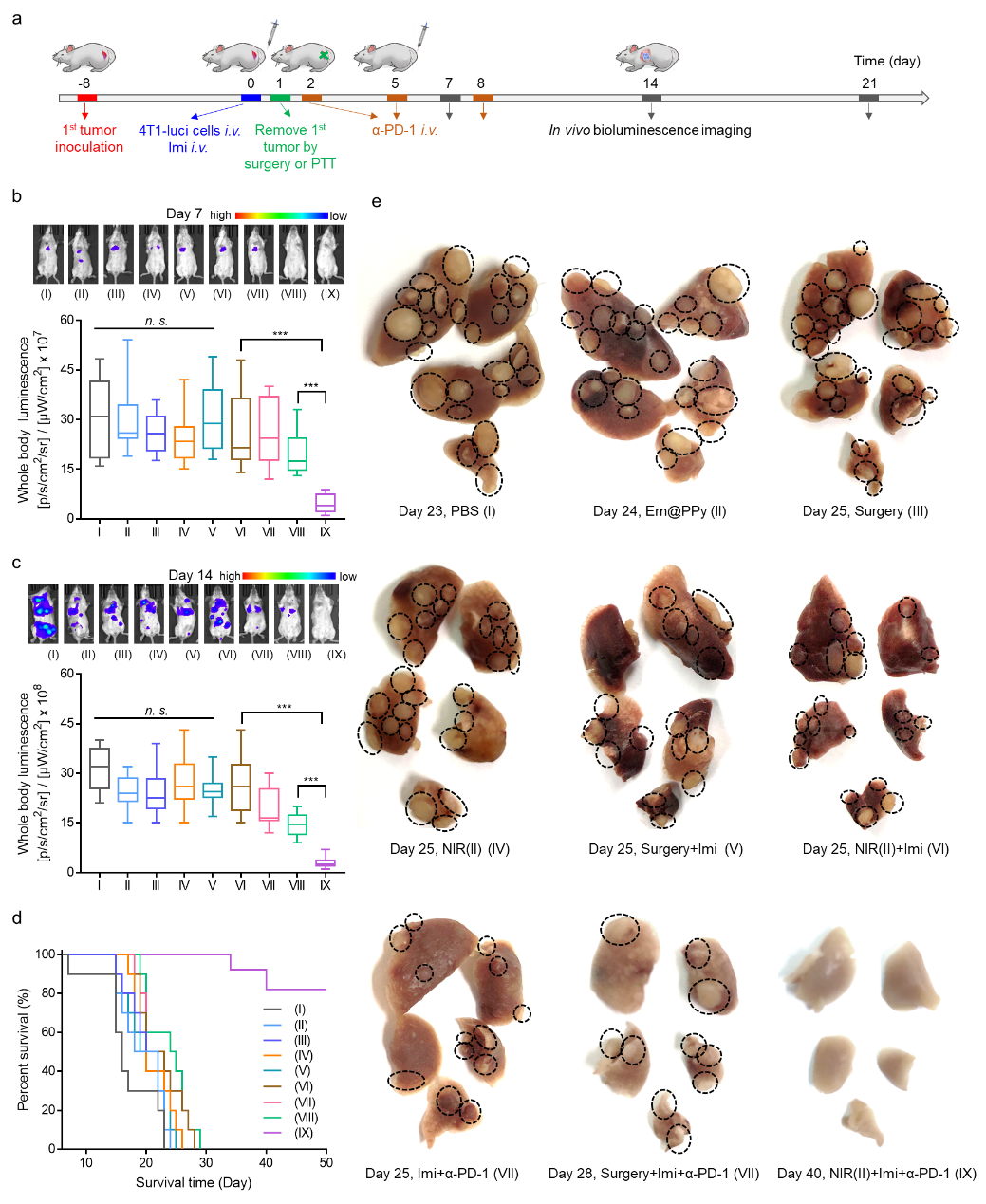
圖5、NIR(II)光熱誘導的ICD預防4T1腫瘤轉移
該研究成功地證明了在實體瘤中,NIR(II)光誘導的熱效應可以比NIR(I)和紅光更均勻,可以在腫瘤更深層次觸發免疫原性癌細胞死亡。NIR(II)光熱可通過激發先天性和適應性免疫來實現有效的腫瘤控制和轉移預防。此外,靜脈注射的紅細胞膜包裹的二維聚吡咯納米片用作NIR(II)光熱全身治療,以實現協同的光熱免疫反應并引發抗腫瘤免疫力,從而抑制全身轉移腫瘤模型發揮驚人的治療作用,最終延長小鼠的生存時間。該策略提供了一種有效的方法,可逆轉腫瘤深處的免疫抑制并與免疫療法協同作用,以改善原發性,遠端性和轉移性腫瘤的治療效果。
該工作得到了國家重點研發計劃(2017YFA0205200和2017YFA0205600)和國家自然科學基金(NOs. 51773191, 81571785, 和31971314)的資助。
該論文發表在ACS Nano上,論文題目為“Near-Infrared II Phototherapy Induces Deep Tissue Immunogenic Cell Death and Potentiates Cancer Immunotherapy”。中國科學技術大學王育才教授和合肥工業大學王峰教授為本文的通訊作者。
- 唐本忠院士/徐峰教授團隊/鄭磊教授團隊合作AM:是“金子”,不僅能增強AIEgen發光,還能提升光療 2023-07-29
- 中科院化學所肖海華研究員團隊《Adv. Mater.》:可降解的近紅外二區假性共軛聚合物光熱劑治療高級別漿液性卵巢癌 2021-12-01
- 中科大王育才教授/白麗教授合作Nano Letters:高分子材料增強自然殺傷性T細胞的腫瘤治療效果 2021-07-21
- 天工大高輝/馬飛賀/余云健 Small:疏水標簽/低溫光熱協同增強腫瘤治療 2025-07-11
- 蘇大鐘志遠/鄧超、蘇大附一院朱曉黎 Nat. Commun.:腫瘤血管適應性、粘附性和可吸收性微球用于可持續的經動脈化學栓塞治療 2025-07-09
- 常州大學王建浩教授團隊《Acta Biomater.》:藥物儲庫型聚合物納米膠束用于腫瘤長效治療的研究成果 2025-07-08
- 東華大學郭睿教授/史向陽教授課題組 Acta Biomater.:仿生納米平臺介導的缺氧-腺苷軸破壞和PD-L1敲除用于增強MRI引導的化學動力學/免疫治療 2025-06-27
