合成的納米顆粒(NPs)不具有主動(dòng)趨化特性,不易跨越常見的生物屏障,一般只能通過EPR效應(yīng)被動(dòng)靶向至腫瘤部位,因此腫瘤富集效率相對(duì)較低。腫瘤的發(fā)生發(fā)展與慢性炎癥緊密相關(guān),而多種腫瘤治療方式也會(huì)引起急性炎癥。中性粒細(xì)胞可以快速響應(yīng)炎癥,大量產(chǎn)生并通過趨化反應(yīng)穿過多道生理屏障到達(dá)炎癥部位。因此中性粒細(xì)胞已被發(fā)展為納米藥物的細(xì)胞載體,用于克服納米藥物遞送過程的多重生理屏障,但如何發(fā)展可實(shí)現(xiàn)高效特異靶向體內(nèi)中性粒細(xì)胞的普適性方法是實(shí)現(xiàn)該思路的關(guān)鍵。
近日,中國科學(xué)技術(shù)大學(xué)王育才教授課題組利用自然界中細(xì)菌等病原體可有效被中性粒細(xì)胞識(shí)別并吞噬的特性,發(fā)展出仿生納米病原體(NPN)體系用于NPs的中性粒細(xì)胞靶向。具體來說,使用細(xì)菌外膜囊泡(OMV)包被NPs制備NPNs,OMVs含有的多種來源于細(xì)菌的病原體分子模式可被中性粒細(xì)胞感知,并介導(dǎo)其被中性粒細(xì)胞的吞噬。攜載NPNs的中性粒細(xì)胞可主動(dòng)趨化至光熱治療(PTT)后的炎癥腫瘤部位,在受到炎癥分子的刺激后中性粒細(xì)胞細(xì)胞膜破裂、將NPNs釋放。釋放出的NPNs通過其包載的順鉑有效殺死殘存的腫瘤細(xì)胞,從而聯(lián)合PTT達(dá)到完全清除腫瘤的效果(圖1)。該策略可廣泛應(yīng)用于任意種類納米/微米顆粒的中性粒細(xì)胞特異靶向,且可應(yīng)用于中性粒細(xì)胞參與的腫瘤/炎癥等多種類型疾病的治療。
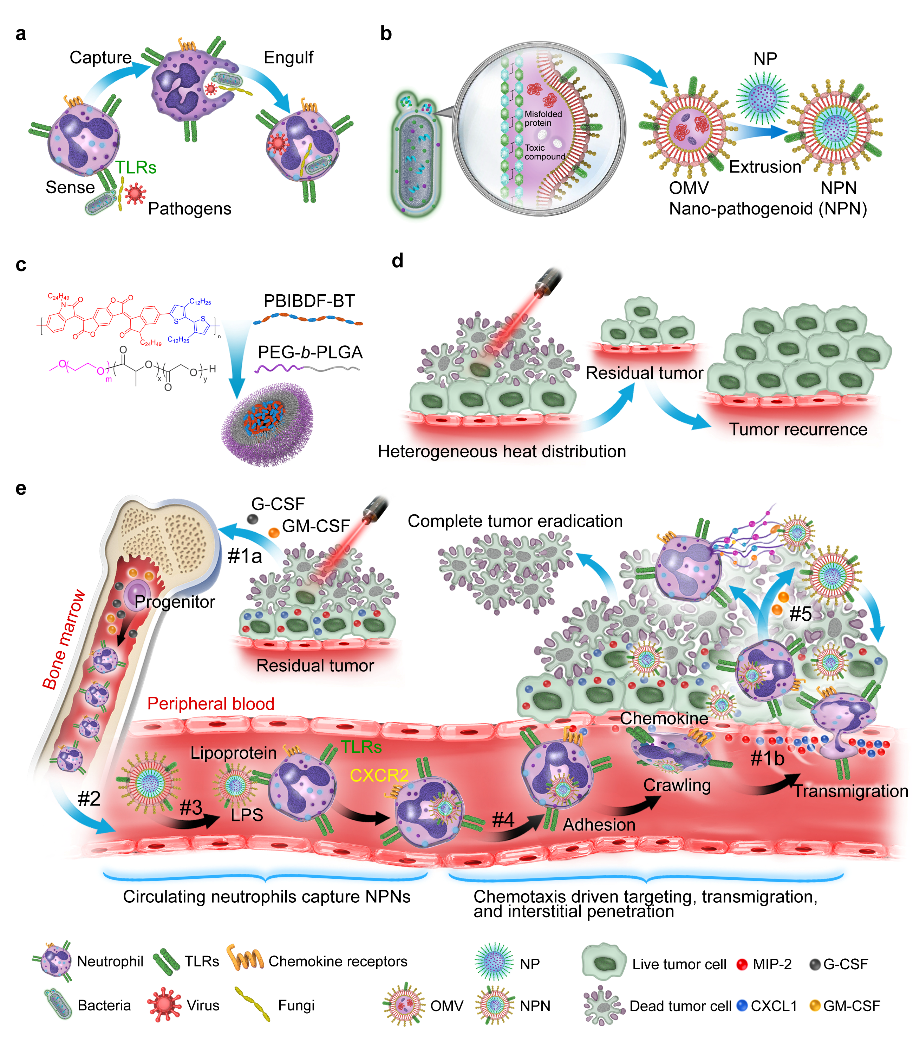
圖1、a. 中性粒細(xì)胞可識(shí)別并吞噬多種病原體。b. NPN制備過程。c. 光熱傳導(dǎo)試劑PBIBDF-BT納米顆粒的制備。d. 由于光的穿透深度有限,PTT處理后的腫瘤會(huì)復(fù)發(fā)。e. PTT聯(lián)合NPN介導(dǎo)的化療的聯(lián)合療法。
研究結(jié)果表明NPNs可有效靶向至循環(huán)的中性粒細(xì)胞,具體分析顯示中性粒細(xì)胞攝取的NPNs量占血液中所有免疫細(xì)胞攝取量的83.4%,提示NPNs靶向循環(huán)中性粒細(xì)胞的高效性和特異性。并且中性粒細(xì)胞可通過主動(dòng)趨化將NPNs攜載至腫瘤部位,NPNs在PTT處理后的腫瘤部位富集明顯增加(圖2)。以上結(jié)果說明血液中循環(huán)的中性粒細(xì)胞可攝取更多的NPNs并將其攜載至PTT處理的腫瘤部位。
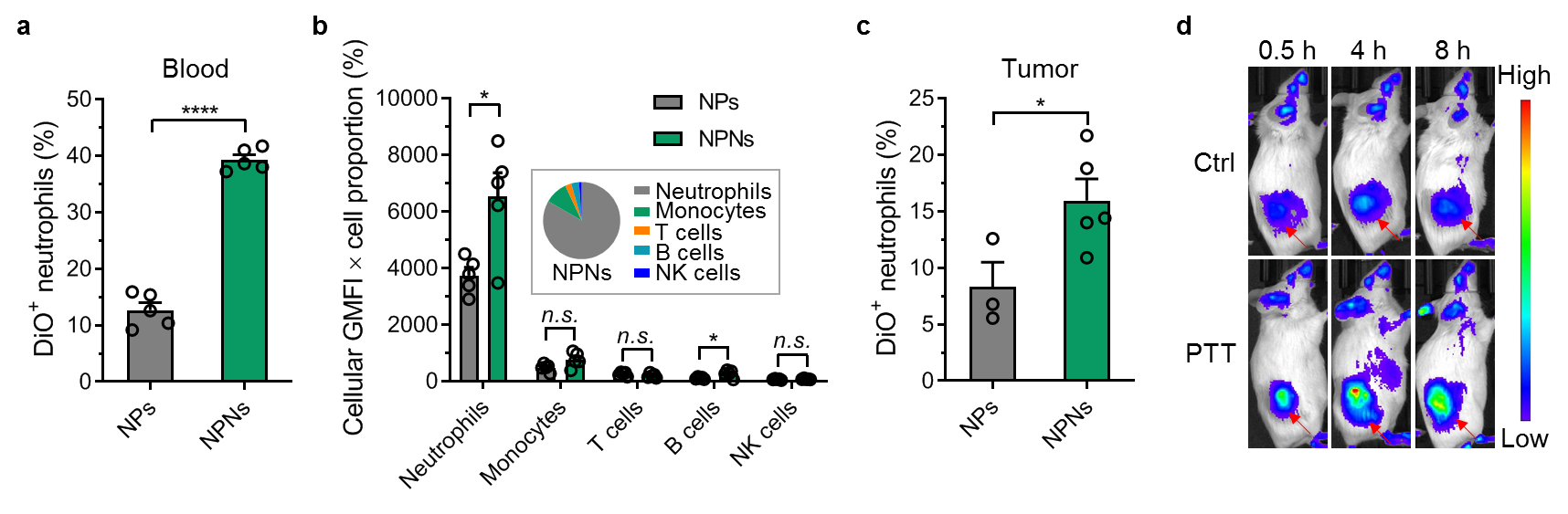
圖2、a. 血液中性粒細(xì)胞攝取NPs或NPNs的比例。b. 血液中免疫細(xì)胞比例乘以其攝取NPs或NPNs的強(qiáng)度用于反映其整體攝取能力。內(nèi)嵌圖為分析每種細(xì)胞攝取NPNs量占血液中所有免疫細(xì)胞攝取總量的比例。c. 腫瘤中性粒細(xì)胞攝取NPs或NPNs的比例。d. NPNs在PTT處理小鼠及對(duì)照小鼠中的分布,箭頭指示腫瘤部位。
到達(dá)腫瘤部位以后中性粒細(xì)胞需要將NPNs快速釋放以保證其殺傷腫瘤細(xì)胞的活性。體內(nèi)實(shí)驗(yàn)結(jié)果顯示在PTT處理的腫瘤組織中,中性粒細(xì)胞可有效釋放NPNs,并且釋放的NPNs可被腫瘤細(xì)胞攝取以行使其殺傷功能(圖3)。

圖3、a. 實(shí)驗(yàn)流程圖。荷載DiO標(biāo)記NPs(NPs@DiO)的DiD標(biāo)記的中性粒細(xì)胞(Neutrophils@DiD)被瘤內(nèi)注射至PTT處理或?qū)φ漳[瘤中,20小時(shí)后通過流式細(xì)胞術(shù)和免疫熒光進(jìn)行分析。b. 轉(zhuǎn)輸?shù)闹行粤<?xì)胞中還含有NPs@DiO的比例。c. 腫瘤組織中NPs@DiO與轉(zhuǎn)輸?shù)闹行粤<?xì)胞或腫瘤細(xì)胞的共定位情況。黃色箭頭指示NPs@DiO與轉(zhuǎn)輸?shù)闹行粤<?xì)胞共定位,綠色箭頭指示NPs@DiO與腫瘤細(xì)胞共定位。
最后作者驗(yàn)證了PTT聯(lián)合包載順鉑的NPNs(NPNs@Pt)對(duì)腫瘤的治療效果。結(jié)果顯示兩次聯(lián)合治療可完全清除所有實(shí)驗(yàn)小鼠的腫瘤組織,并且在觀察期內(nèi)未見復(fù)發(fā),根據(jù)前文結(jié)果推測(cè)是NPNs@Pt在腫瘤中富集的增多介導(dǎo)了PTT處理后殘存的腫瘤細(xì)胞的清除(圖4)。
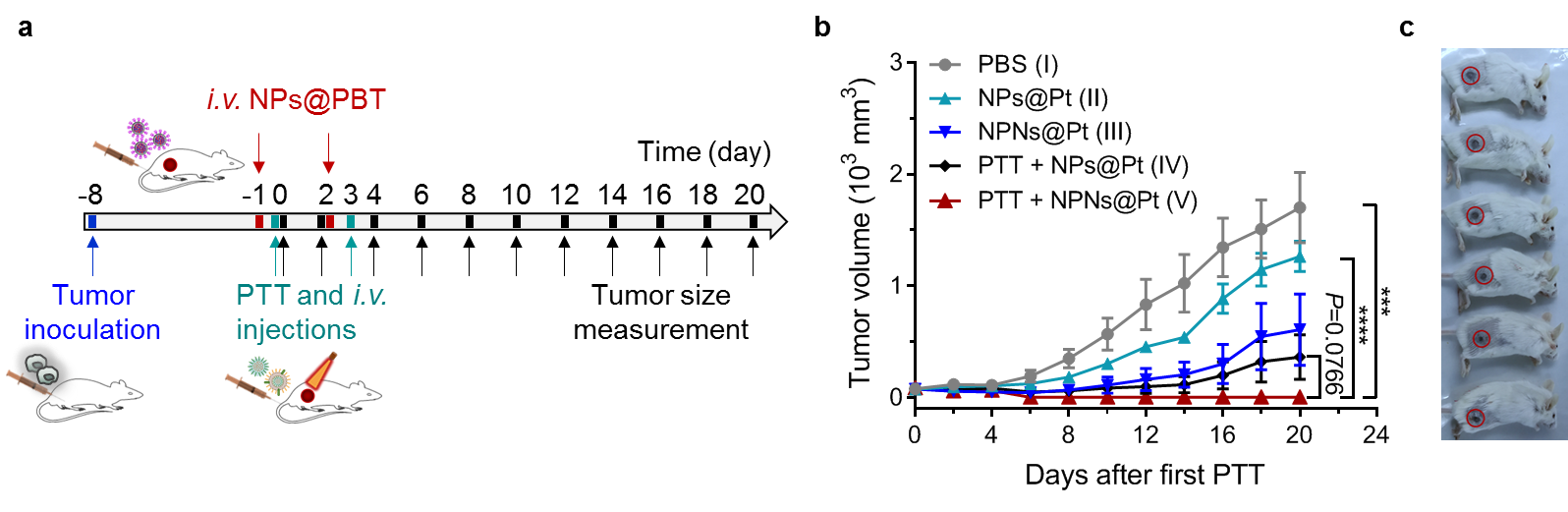
圖4、a. 實(shí)驗(yàn)流程圖。b. 不同處理組小鼠腫瘤生長(zhǎng)曲線。c. PTT + NPNs@Pt處理組小鼠照片顯示腫瘤全部被清除。
該研究以Chemotaxis-Driven Delivery of Nano-Pathogenoids for Complete Eradication of Tumors Post-Phototherapy為題在Nature Communications發(fā)表。王育才教授為該論文的通訊作者,李敏博士和博士生李舒雅為該論文的共同第一作者。該研究工作得到了國家重點(diǎn)研發(fā)項(xiàng)目、國家自然科學(xué)基金、中央高校基本科研業(yè)務(wù)費(fèi)專項(xiàng)基金、廣東省生物醫(yī)學(xué)工程重點(diǎn)實(shí)驗(yàn)室開放項(xiàng)目和安徽省自然科學(xué)基金的資助。
- 山東大學(xué)崔基煒教授團(tuán)隊(duì) ACS Nano: 硬度可調(diào)的聚乙二醇納米顆粒調(diào)節(jié)納米-生物相互作用,增強(qiáng)靶向藥物遞送 2025-06-12
- 上科大葉春洪課題組 Nat. Commun.:超高等離子體手性光學(xué)信號(hào)的構(gòu)筑及動(dòng)態(tài)調(diào)控 2025-06-08
- 四川大學(xué)李建樹教授/謝婧副研究員、大連理工孫文研究員 AFM:一種具有pH響應(yīng)性和軟骨滲透能力的超分子納米顆粒治療骨關(guān)節(jié)炎 2025-04-30
- 東華大學(xué)郭睿教授/史向陽教授課題組《ACS AMI》:樹枝大分子包裹銅鉑雙金屬納米酶用于腫瘤微環(huán)境調(diào)控光熱/催化療法 2025-06-19
- 港中大(深圳)趙征 / 唐本忠團(tuán)隊(duì) ACS Nano :多功能AIE納米馬達(dá)突破腫瘤屏障 - 實(shí)現(xiàn)精準(zhǔn)光診療 2025-05-29
- 山東大學(xué)欒玉霞教授團(tuán)隊(duì) Nat. Nanotech.:發(fā)現(xiàn)解決CAR-T細(xì)胞療法實(shí)體瘤療效受限的有效方法 2025-05-20
